2026创新药抗体&ADC合作大会关注到,一项“特瑞普利单抗联合抗体偶联药物(ADC)一线治疗局部晚期或转移性尿路上皮癌(la/mUC)的III期临床研究代表中国泌尿肿瘤领域首次荣登欧洲肿瘤内科学大会“主席论坛”,研究数据被国际顶尖期刊《新英格兰医学杂志》同步收录,标志中国原研方案获全球学术界“双重认证”。
研究背景与设计
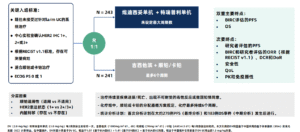
早期Ib/II期研究显示,维迪西妥单抗(DV)联合特瑞普利单抗(T)在la/mUC患者中有效性显著,尤其在HER2表达的患者中表现更佳。基于此,中国开展了RC48-C016开放标签、多中心、随机III期试验,比较DV+T与标准化疗(吉西他滨+顺铂/卡铂)在HER2表达(IHC 1+~3+)的不可切除la/mUC患者中的疗效与安全性。
图片来源:医脉通
研究共纳入484例既往未接受系统治疗的患者,按1:1随机分配至DV+T组(n=243)或化疗组(n=241)。分层因素包括顺铂耐受性、内脏转移及HER2表达水平。肿瘤疗效通过BIRC和研究者根据RECIST v1.1标准进行评估,双主要终点为无进展生存期(PFS)和总生存期(OS)。
关键研究结果
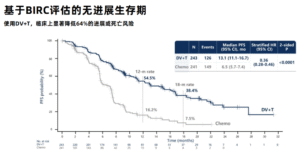
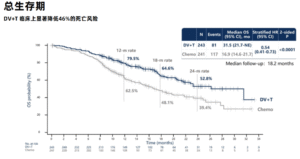
截至2025年3月31日,中位随访18.2个月。DV+T组中位PFS为13.1个月,较化疗组(6.5个月)实现翻倍(HR=0.36;95% CI 0.28~0.46;P<0.0001),中位OS为31.5个月,化疗组为16.9个月(HR=0.54;95% CI 0.41~0.73;P<0.0001)。各亚组(顺铂耐受性、内脏转移状态、HER2表达水平)均显示一致获益。
图片来源:医脉通
图片来源:医脉通
客观缓解率(ORR)方面,DV+T组为76.1%,化疗组为50.2%,其中完全缓解率(CR)达4.5%。安全性显示,DV+T组≥3级治疗相关不良事件发生率为55.1%,显著低于化疗组86.9%,体现了更佳耐受性。

图片来源:医脉通
专家点评与临床意义
特瑞普利单抗是中国首个自主研发PD-1抑制剂,最初获批用于黑色素瘤,随后拓展至UC领域。PD-1单抗与新型ADC的联合,正显著改善患者生存和生活质量。RC48-C016研究首次在HER2表达的la/mUC患者中验证抗HER2 ADC联合免疫治疗一线应用的可行性与高效性。
该研究显示,无论HER2表达水平、顺铂耐受性或肿瘤部位,DV+T方案均显著延长PFS和OS,实现疾病进展或死亡风险显著下降。特瑞普利单抗通过激活T细胞免疫应答,与ADC协同作用,不仅提高初始缓解率,还可能诱导深度持久的免疫应答,这是传统化疗或ADC单药难以实现的。
从药物可及性和卫生经济学角度来看,中国患者能够以相对更低成本获得高效治疗方案,且疗效与安全性兼具,为临床一线选择提供了更多可能。
全球视角与未来展望
RC48-C016研究数据引起国际泌尿肿瘤界高度关注。尽管特瑞普利单抗在欧美尚未全面准入,但全球临床界期待尽早应用该药物。随着中国原研药物通过国际多中心研究获得更多数据支持,未来有望加速登陆欧美市场,实现全球批准,让更多患者受益于高效、可负担的中国创新药。
2026创新药抗体&ADC合作大会强调,中国原研药物在抗体与ADC领域正逐步形成国际影响力,为全球la/mUC治疗格局带来新选择,也为创新药物国际化提供了实践范例。
文章来源:医脉通

