图片来源:医药速览
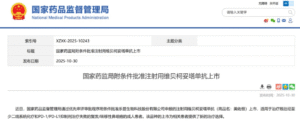
在2026创新药抗体&ADC合作大会关注到的全球创新药热点中,抗体-药物偶联物(ADC)再度成为焦点。2025年10月30日,国家药品监督管理局批准乐普生物的维贝科妥塔单抗(MRG003)上市,用于治疗复发/转移性鼻咽癌。作为靶向EGFR的ADC药物,MRG003的获批标志着我国在精准肿瘤治疗领域的重要突破。紧接着,香港中文大学康伟教授团队于11月3日在《Molecular Cancer》发表综述,系统阐述ADC的结构机制、研发趋势与未来方向。
图片来源:医药速览
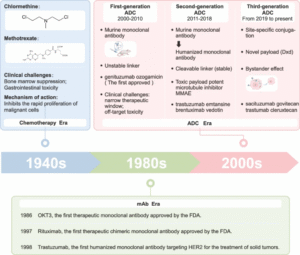
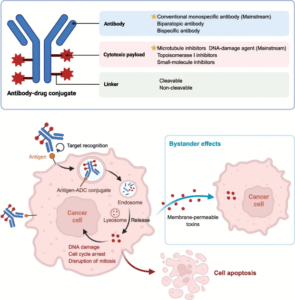
ADC的结构与作用机制
ADC由单克隆抗体、化学连接子和细胞毒载荷三部分组成,其精准性与协同性决定疗效。抗体可选择性识别肿瘤表面抗原,连接子确保药物在血液中稳定、在肿瘤细胞中高效释放,细胞毒载荷则通过抑制微管或损伤DNA直接杀伤癌细胞。新一代拓扑异构酶I抑制剂具备“旁观者效应”,可进一步清除邻近抗原阴性细胞。部分ADC还能诱导免疫原性细胞死亡,激活抗肿瘤免疫反应。
图片来源:医药速览
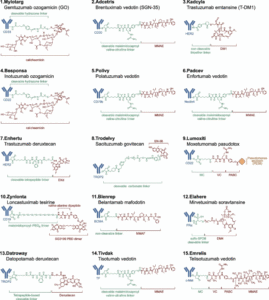
临床应用与研发进展
截至2025年,全球已批准15款ADC药物,覆盖乳腺癌、淋巴瘤、卵巢癌等十余种癌症亚型,正在开展的临床试验超过1300项。ADC的靶点正从血液系统向实体瘤延展,HER2、TROP2、Nectin-4等靶点成为热点。其中,德鲁替康首次实现了HER2低表达乳腺癌的突破,将患者中位无进展生存期从5.1个月延长至9.9个月。
HER3、B7-H3、CEACAM5等新兴靶点的探索,以及ADC与免疫检查点抑制剂、靶向药物联合使用的策略,正成为克服耐药、增强疗效的新方向。
图片来源:医药速览
关键挑战与创新策略
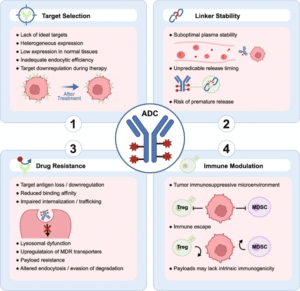
尽管ADC发展迅速,仍面临靶点稀缺、连接子稳定性不足及耐药性复杂等问题。抗原丢失、药物外排及肿瘤微环境免疫抑制都可能导致疗效下降。科研团队正通过开发双靶向ADC、免疫刺激型ADC以及膜通透性载荷等方式应对挑战,提升药物选择性与持久性。
图片来源:医药速览
前沿技术与未来趋势
AI与纳米技术的引入正重塑ADC的研发模式。人工智能可用于预测药物抗体比、连接子稳定性及最佳载荷组合,大幅提高设计效率;纳米载体则改善药物稳定性与穿透性,为治疗脑肿瘤提供新思路。
此外,个性化ADC治疗正在兴起,根据患者分子特征定制药物组合,有望在疗效与安全性间实现平衡。
结论与展望
ADC已成为抗癌药物研发的关键方向,但仍需在分子设计、耐药管理与可及性间取得平衡。未来的发展将从“抗原依赖”向“机制多样化”演进,通过双靶向ADC、PROTAC-ADC和免疫刺激载荷拓展治疗边界。
液体活检与空间组学等新诊断技术将推动ADC实现“反馈驱动、个性化”治疗模式。正如2026创新药抗体&ADC合作大会所强调的那样,智能化设计与国际协作将成为ADC创新的核心驱动力,引领全球精准治疗迈向更高阶段。
文章来源:医药速览

