在2026生物医药产业合作大会关注的全球前沿抗炎研究领域中,免疫球蛋白(IVIG)的工程化突破被认为是未来自免与炎症疾病治疗的重要方向。近日,《科学》(Science)杂志刊发的一项来自国际团队的研究表明,科学家通过精确设计Fc突变体,大幅提高唾液酸化IgG1 Fc(sFc)对抑制性受体 FcγRIIB 的亲和力,使抗炎活性在小鼠模型中提升约100倍,展现出取代传统IVIG的潜力。

图片来源:新药说
一、Fc结构改造激发强抗炎效应
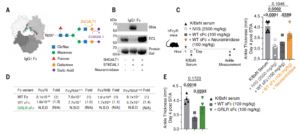
研究团队聚焦IVIG发挥免疫调节作用的关键机制:IgG Fc区N-连接聚糖的唾液酸化,以及I型与II型Fc受体(FcγR与DC-SIGN)之间的信号协同。为了真实模拟人体FcγR系统,研究者使用FcγR人源化(hFcγR)小鼠模型,通过关节炎血清转移模型(STIA)验证IVIG与sFc的效果。
图片来源:新药说
结果显示,标准IVIG(2.5 g/kg)与野生型IgG1 sFc(100 mg/kg)均可显著减轻炎症反应,但sFc的有效摩尔剂量比IVIG低近九倍。该抗炎活性依赖Fc唾液酸化过程和I型、II型Fc受体的协同作用;一旦去除唾液酸或阻断受体结合,疗效即刻消失。
二、定向突变增强抑制性受体结合
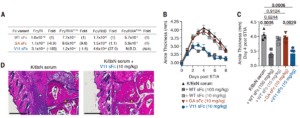
为了进一步提高疗效,研究设计了两种Fc突变体:V11 sFc(增强与抑制性 FcγRIIB 结合)与GA sFc(增强与激活性 FcγRIIA 结合)。在10 mg/kg剂量下,V11 sFc在hFcγR小鼠中显著抑制关节炎炎症,与十倍高剂量的野生型 sFc 效果相当,而GA sFc 即便加量至100 mg/kg仍效果有限。组织学分析进一步证实,V11 sFc可减少免疫细胞浸润、维持关节结构完整,显示其抗炎作用与选择性激活 FcγRIIB 通路密切相关。
值得注意的是,V11 sFc 对 FcγRIIIA 无结合能力,表明该通路在抗炎机制中并非关键。
图片来源:新药说
三、I型与II型受体的协同机制
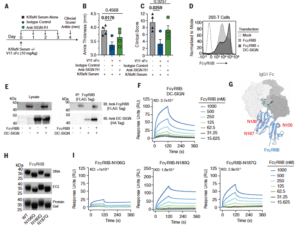
研究还揭示了一个关键发现:II型受体 DC-SIGN (或其小鼠同源物 SIGN-R1)不仅被动参与信号,还能与 FcγRIIB 形成直接物理互作。两者共表达时,可稳定 FcγRIIB 的细胞表面分布并增强其信号传导能力。共免疫沉淀与表面等离子共振(SPR)实验均证实DC-SIGN与 FcγRIIB 之间存在聚糖依赖性结合,这种协同机制为理解免疫球蛋白的抗炎调节提供了新的分子基础。
图片来源:新药说
四、在神经自身免疫性疾病模型中的验证
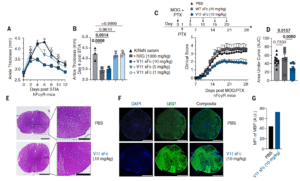
IVIG常用于多发性硬化(MS)等神经炎性疾病。研究团队在实验性自身免疫性脑脊髓炎(EAE)模型中测试V11 sFc,仅以10 mg/kg 剂量、4次给药,就能显著降低hFcγR小鼠的疾病评分。病理切片显示V11 sFc治疗组的髓鞘结构完好、炎症细胞明显减少,而对照组则出现明显脱髓鞘与神经破坏。免疫荧光结果进一步验证其对髓鞘碱性蛋白(MBP)的保护作用。
图片来源:新药说
五、百倍效力,IVIG替代的潜在候选
作为Fc工程化的唾液酸化IgG分子,V11 sFc在动物模型中展现出与IVIG共享的免疫调节机制,却能以低100倍剂量实现相似甚至更优疗效。其有效剂量(10 mg/kg)与FDA近期批准的FcRn阻断疗法相当,但不会造成内源性IgG消耗,从而保留血清IgG的抗感染防御功能。
这一成果不仅展示了Fc结构工程在抗炎药物研发中的巨大潜能,也为开发新一代高效、安全、可规模化生产的免疫疗法奠定了基础。。
在即将举办的2026生物医药产业合作大会上,Fc工程化抗体与免疫调节分子的合作开发有望成为重要议题。研究者普遍认为,基于FcγR通路的分子优化策略,正引领抗炎免疫疗法迈向更高效、更可控的新阶段。
文章来源:新药说

