2025年6月3日,《自然-生物技术》期刊同期发表两篇来自中国科研团队的重磅研究,华东师范大学李大力、刘明耀团队联合临港实验室陈亮团队开发出高性能线粒体碱基编辑器,并首次在动物体内实现线粒体致病突变的原位精准纠正。这一突破为全球约1/5000人口受影响的线粒体遗传病提供了革命性治疗路径。
图片来源网络
一、线粒体疾病:亟待攻克的遗传难题
线粒体作为细胞的“能量工厂”,其基因组(mtDNA)突变会引发多种严重疾病,如Leigh综合征、遗传性视神经病变等。“全球平均每5000人就有1人携带有害mtDNA突变,其中95%是点突变。”李大力教授指出,这类疾病常累及多器官且难以治愈,传统药物仅能缓解症状,而线粒体基因组的特殊性使得CRISPR等常规基因编辑技术难以应用。
尽管学界已开发DdCBE、TALEDs等线粒体编辑工具,但受限于编辑效率和精度,难以构建高突变比例的动物模型,更无法实现有效治疗。“构建疾病模型和开发高精度编辑器是突破瓶颈的关键。”研究团队明确了技术攻关的双重目标。
二、双重突破:从模型构建到突变纠正
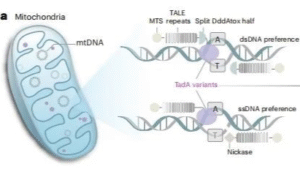
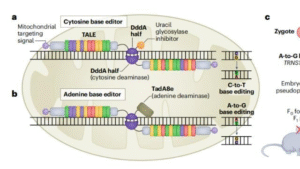
在第一项研究中,团队通过改造腺嘌呤脱氨酶TadA-8e,开发出高性能线粒体腺嘌呤碱基编辑器eTd-mtABEs。ChinaBio合作大会认为该工具通过引入高活性TadA变体,使线粒体编辑效率较传统sTALEDs平均提升6.9倍,在大鼠细胞系中最高达145倍,且脱靶风险极低。
利用eTd-mtABEs,研究团队成功构建全球首例遗传稳定的Leigh综合征及感音神经性耳聋大鼠模型。“这些模型能精准模拟人类疾病表型,为机制研究提供了关键工具。”陈亮研究员强调,模型大鼠表现出运动功能障碍和心脏损伤,与临床症状高度吻合。
第二篇研究中,团队聚焦突变纠正,通过工程化设计60个DdCBE变体,筛选出1333NC-DddA11-K1389A变体,成功将“旁观者编辑”风险降至最低。实验显示,该变体在Leigh综合征大鼠模型中实现平均53%的致病mtDNA纠正率,受损的肌肉和心脏功能恢复至野生型水平。
三、技术革新:从实验室到临床的跨越
这两项研究形成了完整的技术链条:从编辑器改造到疾病建模,再到体内突变纠正,首次在活体动物中验证了线粒体遗传病基因治疗的可行性。《自然-生物技术》同期配发的“新闻与观点”评价:“中国团队的工作标志着线粒体基因编辑领域进入新的发展阶段。”
与传统治疗相比,该技术具有显著优势:一是原位纠正避免了外源基因导入的风险;二是编辑效率突破了致病突变“阈值”难题;三是动物模型验证了治疗的安全性和有效性。德国汉诺威莱布尼茨大学教授Jens Boch指出:“这重新引发了学界对TALE基因编辑技术的关注,为线粒体疾病治疗提供了全新范式。”
四、未来展望:开启线粒体疾病治愈新纪元
研究团队透露,下一步将优化编辑工具的递送系统,探索向临床转化的可能性。“我们的最终目标是开发出安全有效的基因治疗产品,让线粒体遗传病患者重获健康。”刘明耀教授表示,该技术不仅适用于Leigh综合征,还可扩展至其他mtDNA点突变相关疾病,预计能覆盖86%的线粒体致病突变类型。
图片来源网络
ChinaBio合作大会表示,随着技术的迭代,线粒体疾病治疗有望从症状缓解迈向根源性治愈。这两项研究也彰显了中国在基因编辑领域的创新实力,为全球遗传病防治贡献了“中国方案”。正如李大力所言:“从基础研究到临床应用,我们正在打通线粒体疾病治疗的全链条,这将是一场惠及千万患者的医学革命。”
文章来源:科学网


