针对CD19靶点的CAR-T细胞治疗技术,在儿童复发或难治型B细胞急性淋巴细胞白血病(B-ALL)的治疗中已展现出显著疗效。ChinaBio合作大会了解到,多项临床研究证实,肿瘤负荷较低且CAR-T细胞在体内存留时间较长的病例,治疗效果更为理想。早前发布的“儿科白血病过继治疗02”(PLAT-02)一期研究结果——该项I/II期临床试验采用的SCRI-CAR19为第二代CAR结构,包含小鼠来源的FMC63单抗序列及4-1BB共刺激域——显示接受该疗法患者的1年无白血病生存(LFS)、无事件生存(EFS)和总生存(OS)率分别达到55%、51.2%与69.5%。
早期CAR丢失(即输注后6个月内CAR-T细胞持续消失)已被识别为儿童B-ALL远期复发的重要预测因子。在PLAT-02的I期试验中发现,淋巴细胞清除(LD)前骨髓中CD19抗原表达水平偏低(<15%),或输注后10–14天内CAR-T细胞数量快速下降(以第10天与第14天外周血CAR-T细胞比例比值≥1.5为界)的患者,更易出现早期CAR丢失。

图片来源:细胞知聊
2025年8月,《血液》(Blood)期刊刊登了一项题为“PLAT-02与PLAT-03研究结果:儿童B-ALL中CD19 CAR-T细胞治疗及CD19表达型T-APC支持的评估”的研究,公布了PLAT-02II期阶段的研究结果(II期推荐剂量[RP2D]为每公斤体重1×10^6个CAR阳性T细胞)。同时,该文也介绍了一项并行开展的先导研究PLAT-03,旨在前瞻性评估为具有早期CAR丢失高风险的患者输注外源性CD19抗原(以T-APC形式),以延长CAR-T细胞持续性的安全性与可行性。两项研究的试验设计详见图1。本文将对相关主要内容进行解读。
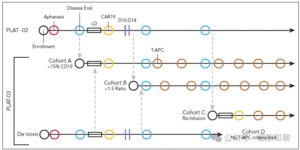
图1,PLAT-02 与PLAT-03的研究方案概述。
图片来源:细胞知聊
研究结果
PLAT-02 II期研究纳入患者及基线特点
PLAT-02研究的II期部分共纳入120例患者(图2A),其中72例进入主要疗效分析。
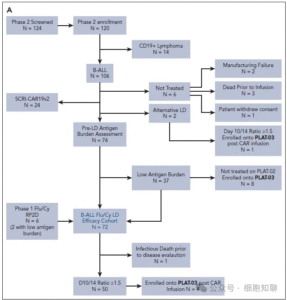
图2A,CONSORT图。(A)PLAT-02二期入组患者。
图片来源:细胞知聊
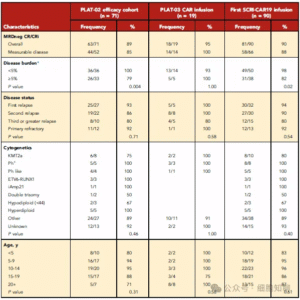
该疗效人群的基线临床特征见表1。患者中位年龄为12.5岁(区间:1–25岁),其中12例(17%)属于原发难治性ALL,29例(40%)曾有造血干细胞移植(HCT)史。淋巴细胞清除前,患者骨髓中CD19+白血病细胞的中位比例为3.6%(区间:0–96%),包括19例(26%)已达到骨髓微小残留病阴性(MRDneg)且无髓外病灶;LD时,14例(20%)存在中枢神经系统(CNS)浸润(其中13例为CNS2,1例为CNS3)。
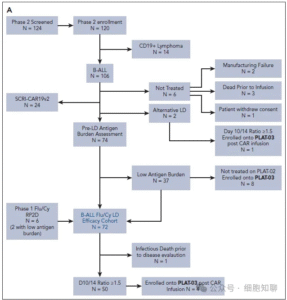
图2A,CONSORT图。(A)PLAT-02二期入组患者。
图片来源:细胞知聊
SCRI-CAR19治疗的临床响应及安全性特征
疗效队列中71例可评估患者,至第63天时89%达到MRDneg的完全缓解(CR)(表2)。输注前有可测量病灶的52例患者中,85%实现MRDneg CR。所有14例CNS浸润患者均达到CNS阴性。SCRI-CAR19治疗的1年及2年LFS分别为0.71(95% CI:0.58–0.81)和0.64(95% CI:0.51–0.75);EFS率分别为0.65(95% CI:0.53–0.75)和0.56(95% CI:0.44–0.67);OS率则为0.76(95% CI:0.64–0.84)和0.68(95% CI:0.55–0.77)(图3A–C)。27例患者(38%,含19例BCA缺失者)在缓解后接受巩固性异基因HCT(cHCT),中位时间为CAR-T输注后5个月(区间:2–42个月)。
表2,应答特征
图片来源:细胞知聊
按LD时疾病负荷分组(高负荷定义为骨髓浸润≥5%),高负荷组MRDneg CR率较低(79% vs 100%;P=0.004)。低负荷患者生存表现优异,1年LFS为0.91(95% CI:0.76–0.97),EFS与OS均为0.94(95% CI:0.79–0.99);高负荷患者1年LFS、EFS、OS则分别为0.42(95% CI:0.23–0.60)、0.35(95% CI:0.20–0.51)、0.59(95% CI:0.41–0.73)(P=0.0004;P<0.0001;P=0.0005)(图3D–F)。
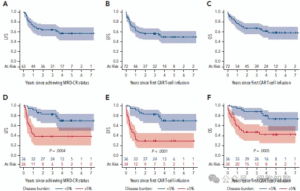
图3 A-F,PLAT-02研究生存分析;PLAT-02 2期疗效队的低与高疾病负担生存分析。
图片来源:细胞知聊
原发难治患者相比复发患者,在LFS(P=0.03)和EFS(P=0.04)上均有显著优势。原发难治亚组(n=12)的1年EFS和OS估计值均达0.92(95% CI:0.54–0.99),实现MRDneg CR的11例患者1年后全部仍处于缓解状态(LFS为1.00)。而复发过一次及以上的患者(n=60),1年LFS、EFS、OS分别为0.65(95% CI:0.50–0.76)、0.59(95% CI:0.46–0.71)、0.73(95% CI:0.60–0.82)。
18例复发患者中,12例出现CD19抗原丢失,其中8例发生于CAR丢失之后(中位间隔4个月;区间:2–39个月)。CD19阳性复发者中6例有3例先发生CAR丢失,CD19阴性复发者中12例有5例先出现CAR丢失。CD19阳性复发中位时间为12个月(4–41个月),阴性者则为5个月(3–16个月)。
SCRI-CAR19治疗最常见的不良事件包括细胞因子释放综合征(CRS)(总体92%;1级53%、2级26%、3级10%、4级3%)和神经毒性(总体53%;1级24%、2级13%、3级15%、5级1%)。CRS中位发生时间为第5天(0–10天),持续4天(1–21天);神经毒性中位发生为第7天(1–11天),持续2天(1–62天)。共37例(51%)接受了免疫调节治疗,包括35例(49%)使用托珠单抗、23例(32%)糖皮质激素、8例(11%)阿那白滞素。2例患者因持续神经毒性(+26、+39天)和COVID-19相关血细胞减少(+478、541、547、555天)接受西妥昔单抗以清除CAR-T细胞,但未成功,不过神经毒性症状有所缓解。
PLAT-03研究的基本特征与临床结果
PLAT-03共纳入26例患者,其中14例由PLAT-02转入,12例为直接入组(图1、图2B)。患者中位年龄17.5岁(1–29岁),53.8%曾有至少1次HCT史(表1)。
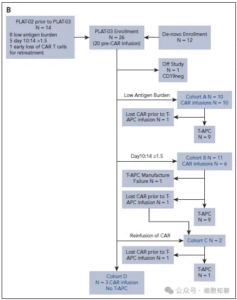
图2B,CONSORT图。(B)PLAT-03二期入组患者。
图片来源:细胞知聊
研究尝试为23例患者制备T-APC(外源CD19抗原呈递T细胞),其中22例使用原本制备SCRI-CAR19的单采样本,1例进行了二次单采。最终22例成功获得T-APC产品。
PLAT-02/03研究中,10例进入队列A(低CD19抗原负荷,中位5%),11例进入队列B(早期CAR-T快速减少),2例为队列C(再治疗组),3例为队列D(不符合T-APC条件)。多数患者接受≥1次T-APC输注;值得注意的是,队列A中8例伴有早期CAR-T减少,队列B中3例伴有低抗原负荷。
PLAT-03中接受SCRI-CAR19治疗的19例患者,MRDneg CR率为95%。全体PLAT-03接受治疗患者的1年及2年EFS分别为0.68(95% CI:0.46–0.83)和0.60(95% CI:0.38–0.76),OS分别为0.96(95% CI:0.75–0.99)和0.76(95% CI:0.54–0.88);1年及2年LFS分别为0.70(95% CI:0.47–0.84)和0.65(95% CI:0.42–0.81)(图3G–I)。6例接受了巩固cHCT,其中3例移植前已失去BCA。
整个PLAT-03队列共10例复发,8例发生于接受SCRI-CAR19治疗的患者中(含1例CD19阴性复发和7例阳性复发)。由PLAT-02转入的2例复发患者均保留CD19表达。
19例患者共接受72次T-APC输注,中位每例3次(1–6次),首次输注中位时间为CAR-T输注后第30天(17–66天)。T-APC输注耐受良好,未引起CRS或神经毒性,仅发生2例3级不良事件:发热性中性粒细胞减少(1例)和输液反应(1例)。
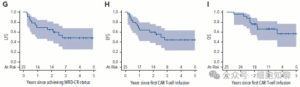
图3 G-I,PLAT-03研究生存分析。
图片来源:细胞知聊
PLAT-02与PLAT-03联合分析中的CAR-T细胞动力学与持久性
PLAT-02和PLAT-03中共90例患者接受氟达拉滨/环磷酰胺预处理后输注SCRI-CAR19。流式细胞术检测外周血(PB)中CAR-T细胞峰值平均为186个/μL(0–5843),中位出现在第11天(0–22天);以T细胞百分比计,CAR-T细胞峰值平均为21.6%(0–84.1%)(图4A),同样中位出现于第11天(0–21天)。
高CD19抗原负荷患者显示出较高的曲线下面积(AUC)(P=0.03),但峰值无显著差异(P=0.11;图4B)。高疾病负荷(P=0.01;P=0.003)、重度CRS(P=0.01;P=0.0034)及重度神经毒性(P=0.00002;P=0.00009)患者,其峰值和AUC均存在显著差异(图4C–E)。
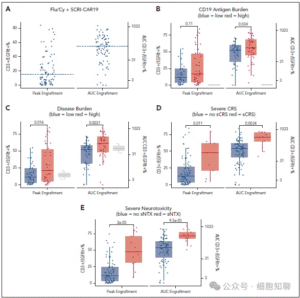
图4,SCRI-CAR19的植入。
图片来源:细胞知聊
未接受T-APC但达到MRDneg CR的患者,BCA法检测CAR-T中位持续时间为12.9个月,早期CAR丢失比例为0.46(图5A)。接受T-APC的患者早期CAR丢失比例较低,为0.19(图5B)。与符合T-APC条件但未加入PLAT-03、仅接受CAR-T治疗的患者相比,未接受T-APC组早期丢失比例为0.56,而T-APC组表现出更好的持续性(P=0.03)。
进一步分析T-APC对预防早期CAR丢失的潜在效果,在低抗原负荷和早期快速减少两个亚组中,未接受T-APC的低负荷组早期丢失比例为0.53,高于高负荷组(0.36),但持续性改善未达显著差异(P=0.07;图5C)。低负荷患者中,T-APC输注未带来显著持续性改善(图5D;P=0.16)。未接受T-APC的快速减少亚组早期丢失比例为0.57,显著高于非快速减少组(0.19;P=0.02;图5E)。而接受T-APC的快速减少患者,早期丢失比例降至0.20(图5F;P=0.05)。
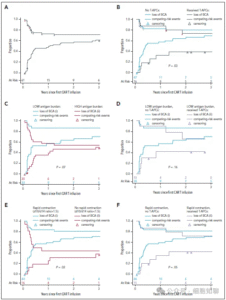
图5,CAR持久性。
图片来源:细胞知聊
结论
采用氟达拉滨/环磷酰胺淋巴细胞清除预处理后输注SCRI-CAR19,在儿童和青年B-ALL患者中展现出较高的缓解率,高肿瘤负荷组中有82%达到MRD阴性完全缓解。ChinaBio合作大会认为特别值得注意的是,在低负荷状态及原发难治性疾病的早期干预中,该疗法表现出卓越的长期无白血病生存,低负荷亚组1年L率达91%,这一数字迄今未有前人报道,也与既往研究一致,再次确认低疾病负荷对治疗结果的积极影响。
对这一临床试验的深入理解,将对未来商业化产品的开发策略以及针对儿童和青年B-ALL患者的新一代细胞治疗方法提供 valuable 的参考。
文章来源:细胞知聊


