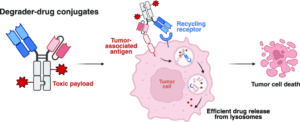
2026创新药抗体&ADC合作大会了解到,为应对抗体药物偶联物(ADC)需依赖高效抗原内化、而细胞外靶向蛋白降解(eTPD)策略细胞毒性不足的两大瓶颈,美国加利福尼亚大学旧金山分校(UCSF)James A. Wells团队在《Journal of the American Chemical Society (JACS)》发表研究,提出并验证了全新的“降解剂-药物偶联物”(Degrader-Drug Conjugate, DDC)概念。这一平台兼具eTPD的膜蛋白降解能力与ADC的高效毒素递送功能,为抗体偶联疗法打开新路径。

图片来源:医药魔方
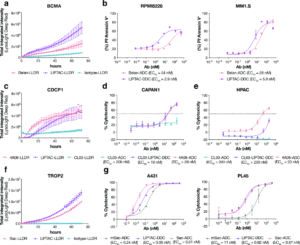
研究显示,基于低密度脂蛋白受体(LDLR)的降解剂LIPTAC可在保持选择性的同时高效降解膜蛋白;当其与细胞毒性药物偶联后,构建出的DDC在体外细胞毒性较传统ADC最高提升达20倍。该成果为下一代抗体疗法提供了更广泛的靶点适用性与更强抗癌潜力。
图片来源:医药魔方
一、从LDLR筛选到LIPTAC构建
研究团队首先通过四轮噬菌体展示筛选,针对LDLR膜近端的EGF样结构域(避免干扰LDL结合),获得了高亲和、高特异性的抗体。
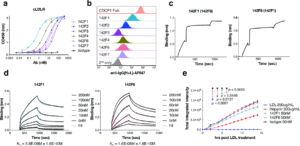
图片来源:医药魔方
随后,他们以此为基础,构建了名为LIPTAC(Lipid receptor-targeted degrader)的双特异性分子:
一端是抗LDLR抗体142F1;
另一端是抗EGFR抗体西妥昔单抗(Cetuximab);
同时通过Fc结构域改造稳定连接两者,并去除免疫激活功能。
LIPTAC能高效、选择性地降解多种治疗相关膜蛋白,验证了其在细胞表面蛋白靶向降解领域的可行性。
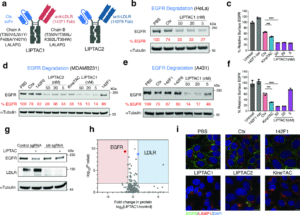
图片来源:医药魔方
二、DDC:融合eTPD与ADC机制的双功能平台
鉴于ADC和eTPD均依赖溶酶体介导的内化与蛋白水解路径,研究团队进一步假设:若将二者结合,可显著增强ADC效力。
基于此,他们将LIPTAC与KineTAC作为载体,与细胞毒性VcMMAE(抗微管药物)偶联,DAR值约为2.6,成功构建出降解剂-药物偶联物(DDC)。
实验结果显示:
DDC仅对表达靶抗原的细胞表现出强杀伤活性;
对阴性细胞无显著毒性;
当使用溶酶体抑制剂Bafilomycin A后,DDC杀伤活性显著下降,说明毒素确实在溶酶体中释放。
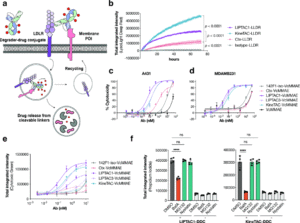
图片来源:医药魔方
三、DDC的普适性验证
为验证该策略的广泛适用性,研究团队将DDC概念应用于多种临床ADC靶点,包括BCMA、cCDCP1、TROP2等。
结果发现:
对于中等表达或内化效率较弱的靶点,DDC展现出远超传统ADC的杀伤效果;
对于高度内化的靶点(如TROP2),DDC的提升效果不明显;
这表明DDC并非取代ADC,而是为ADC难以覆盖的靶点类型提供新的解决方案。
图片来源:医药魔方
四、意义与展望
DDC的提出不仅是一种机制层面的创新融合,更代表了抗体偶联疗法的功能扩展:
- 通过将降解剂模块化整合入抗体偶联结构,弥补ADC对高内化靶点的依赖性;
- 同时强化eTPD的毒性递送能力,实现精准、高效、选择性的靶向杀伤;
- 该设计还可延展至放射性核素、激酶抑制剂、免疫调节分子等多类payload。
随着分子结构与药代动力学的进一步优化,DDC有望成为ADC之后的又一里程碑式平台技术,为2026创新药抗体&ADC合作大会关注的抗体工程、偶联载体设计与精准药物递送领域提供全新方向,也为更多难治性实体瘤带来潜在治疗突破。
文章来源:医药魔方

