随着上海国际生物医药合作大会的临近,业界对创新分子机制药物的关注持续升温。近日,耶鲁大学教授、PROTAC技术开创者Craig Crews创立的生物技术公司Halda Therapeutics宣布,其first-in-class口服RIPTAC药物HLD-0915在治疗转移性去势抵抗性前列腺癌(mCRPC)患者的I/II期临床研究中取得积极成果,标志着这一新兴技术路线迈入临床验证关键阶段。
在这项首次人体试验中,HLD-0915在接受过多线治疗的晚期mCRPC患者中表现出良好的安全性与耐受性,同时呈现出抗肿瘤活性信号,包括前列腺特异性抗原(PSA)和循环肿瘤DNA(ctDNA)水平下降,以及RECIST评估标准下的部分缓解结果。Halda总部位于美国康涅狄格州,专注于RIPTAC技术的研究与应用,利用“hold and kill”机制探索癌症与其他复杂疾病的治疗潜力。
图片来源:医药魔方
RIPTAC全称为Regulated Induced Proximity Targeting Chimeras(调节诱导接近靶向嵌合体),其核心机制是通过将两种蛋白质拉近形成复合体,从而在特定细胞中实现精准功能调控。以癌症治疗为例,RIPTAC分子的一端结合肿瘤中特异富集的靶蛋白,另一端结合对细胞生存至关重要的关键蛋白;当两者同时存在时,RIPTAC促使它们形成复合物,导致关键蛋白功能失活,最终引发肿瘤细胞死亡。
HLD-0915通过同时结合雄激素受体(AR)和BRD4两种蛋白形成三聚体复合物,从而抑制BRD4功能并实现抗肿瘤作用。在临床前模型中,口服HLD-0915治疗可显著缩小肿瘤、降低PSA水平,并在耐药模型中表现出良好的疗效指标。

图片来源:医药魔方
2025年2月,Halda宣布HLD-0915正式启动首个人体临床试验(NCT06800313)并完成首例患者给药。该I/II期、开放标签、多中心研究旨在评估口服HLD-0915在mCRPC患者中的安全性、耐受性、药代动力学(PK)、药效学(PD)及抗肿瘤活性。研究采用每日一次口服给药,21天为一周期,剂量组包括12.5 mg、25 mg、50 mg和100 mg。
图片来源:医药魔方
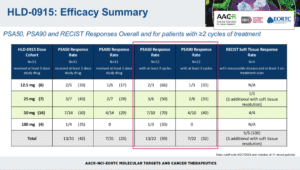
截至数据截止时,共有31例患者接受至少一剂治疗,其中13例(42%)达到PSA50缓解,7例(23%)达到PSA90缓解;在完成至少两个治疗周期的22例患者中,59%实现PSA50缓解,32%达到PSA90缓解。25 mg与50 mg剂量被确认为II期扩展试验推荐剂量。在10例接受50 mg HLD-0915治疗的患者中,70%达到PSA50缓解,40%达到PSA90缓解,所有5例可测量病灶患者均在首次反应评估中获得部分缓解(PR)。

图片来源:医药魔方
安全性数据显示,各剂量组的治疗相关不良事件(TRAEs)发生率低且大多为轻度,≥3级不良事件均可逆且可恢复。

图片来源:医药魔方
Halda计划于2025年底启动II期扩展研究,而HLD-0915此前已获得FDA快速通道资格认定。
业内专家指出,RIPTAC机制代表了靶向蛋白调控领域的重要进化方向,为精准肿瘤治疗开辟了全新路径。伴随上海国际生物医药合作大会持续聚焦创新药物研发与国际协同,这一突破性成果有望推动产业资本、科研创新与临床转化的进一步融合,为全球生物医药生态注入新的动力。
文章来源:医药魔方


