在ChinaBio创新药大会持续聚焦“从科学到临床”的创新语境下,全球细胞与基因治疗(CGT)领域迎来一项具有里程碑意义的研究突破。近日,斯坦福大学医学院联合多家机构在《自然》子刊发表最新成果,提出了一种新型工程化T细胞平台,通过过表达膜锚定信号接头分子 MT-SLP-76,成功降低了CAR-T细胞的激活阈值,使其能够识别并有效杀伤抗原低表达的肿瘤细胞,从根本上解决了长期困扰临床的“抗原逃逸”难题。

图片来源:新药说
长期以来,CAR-T细胞疗法在血液肿瘤中取得显著疗效,但在实体瘤或抗原密度较低的肿瘤类型中常面临疗效不足的瓶颈。肿瘤细胞通过下调靶抗原水平逃避免疫监测,使工程化T细胞“识别不到目标”而失效。相比之下,天然T细胞受体(TCR)能对极低抗原水平作出反应,然而CAR结构的信号传导效率受限,难以复制这种高敏感性。
此次研究的关键创新在于引入 MT-SLP-76 —— 一种经设计的膜锚定信号分子。它将原本位于胞浆中的SLP-76直接锚定至细胞膜上,从而绕过ZAP-70招募受限的环节,即使缺乏LAT复合体,也能有效传导信号。研究显示,这一改造显著增强了CAR-T细胞的信号放大能力,使其能在抗原极低表达的情况下依然保持活性。

图片来源;新药说
体外实验中,MT-SLP-76与多种CAR结构(包括CD19、CD22、HER2和BCMA)共表达时均表现出卓越效能。例如,在仅有数百个CD19分子的Nalm6-CD19模型中,改造后的CAR-T细胞IL-2分泌和肿瘤杀伤活性显著提升,其抗原反应阈值从600至近25万分子/细胞均保持稳定。针对低抗原白血病模型,MT-SLP-76共表达的CD22 CAR-T不仅实现持续肿瘤清除,还显著提高了细胞扩增能力,而常规CAR-T仅能延缓病情进展。
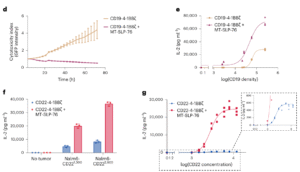
图片来源:新药说
图片来源:新药说
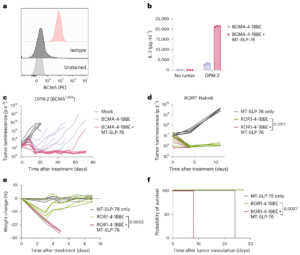
在多发性骨髓瘤模型中,MT-SLP-76同样显著增强了BCMA CAR-T的抗肿瘤活性,使低BCMA表达细胞(1,200分子/细胞)也能被精准清除。进一步分析发现,该增强并未导致过度激活或T细胞耗竭,其中央记忆(TCM)与干细胞记忆(TSCM)比例与对照组相当,说明疗效提升的同时仍保持良好持久性。
图片来源:新药说
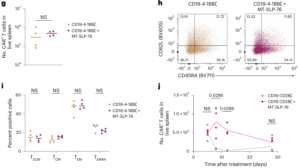
分子机制研究揭示,MT-SLP-76通过增强 ITK-PLCγ1 信号通路放大下游NFAT活性,是实现信号敏感化的关键环节。突变实验进一步证实,若破坏与ITK或PLCγ1结合的位点,其增强作用完全丧失。这说明MT-SLP-76的功能高度依赖于对关键信号节点的精准调控。

图片来源:新药说
此外,单细胞RNA测序结果显示,MT-SLP-76对CAR-T细胞整体转录程序影响有限,细胞主要依抗原暴露状态聚类,表明其增强机制具有特异性与安全性。不过,研究团队也指出,在某些正常组织中存在低水平抗原表达时,MT-SLP-76可能缩小治疗窗口,例如BCMA在基底神经节的轻微表达或ROR1靶点的潜在靶外毒性。未来,研究者计划通过逻辑门控和双抗原识别策略进一步优化安全性。
这一成果不仅解决了CAR-T细胞在低抗原环境下“失灵”的难题,也为未来构建更灵敏、更持久的免疫细胞疗法提供了新思路。业内专家认为,该研究的意义已超越单一肿瘤类型,对所有受抗原下调影响的免疫治疗策略都具有启示作用。
随着ChinaBio创新药大会持续推动创新药物与前沿疗法的临床转化,这类基础研究的突破无疑将成为产业界关注的焦点。未来,如何将MT-SLP-76平台与国内CAR-T开发管线结合,或将成为中国细胞治疗创新的新机遇窗口。
文章来源:新药说


