
图片来源:Manifold Bio
在近期备受瞩目的生物医药管线CGT合作大会上,生物医药创新领域传来重磅消息:Manifold Bio 正式开源其突破性的 AI library——mBER,该技术专为设计 epitope-specific antibodies(表位特异性抗体)而生,将彻底颠覆 in vivo 优先 的药物发现模式。
为有力展示 mBER 的核心实力,Manifold Bio 开展了迄今为止业界报道的最大规模 de novo 抗体实验——在一个测量超过1亿次 protein–protein interactions(蛋白质-蛋白质相互作用)的实验中,测试了超过100万种针对145个多元靶点的设计。研究结果令人振奋:该平台成功识别了约一半测试靶点的 specific binders(特异性结合剂),并在最佳 epitopes(表位)上实现了高达40% 的成功率,性能表现已比肩 state-of-the-art(业界最先进)的方法。
mBER 的核心价值在于其与 Manifold Bio 大规模 in vivo multiplexing technology 的深度整合,实现了数百万种设计在生命系统(living systems)中的直接筛选。两者共同构成了 Manifold 的 direct-to-vivo drug discovery platform(直达体内药物发现平台)的基石,成功弥合了 AI-guided design(AI指导设计)与 biological translation(生物学转化)之间的巨大鸿沟。
目前,mBER 已被迅速部署,以推进一系列 tissue-targeted medicines(组织靶向药物)的研发管线,并同时利用由此生成的海量数据,构建 organism-scale models of biology(生物学的有机体规模模型)。
突破壁垒:AI 驱动的体外向体内转化战略
长期以来,人工智能(AI)极大地变革了药物发现的传统试错流程。然而,大多数设计迭代仍停留在体外(in vitro)细胞测试阶段。药物发现的终极挑战在于转化率:药物必须在患者体内有效,但其设计却依赖于还原论系统。居高不下的临床失败率,正亟待颠覆性解决方案。
Manifold Bio 的战略愿景是:实现实验通量与 AI-guided iteration 在体内系统(in vivo systems)中的爆炸式增长。这不仅使研发无限接近人类生物学,更是迈向 zero‑shot drug design(零样本药物设计)的关键一步——即从期望的治疗特征直接设计出在患者身上“just works”的分子。
实现这一愿景,单一的机器学习(ML)工具远远不够。Manifold 的核心方法是 ML2:“Machine Learning with Multiplexed Libraries”(机器学习与多重库),它将 ML-guided design 与大规模并行分子合成及测量技术高效结合。
凭借 ML2,Manifold 成功打造了业界首个 direct-to-vivo drug discovery platform,从而释放了 AI-guided protein design 的全部潜能。该平台拥有独特的技术壁垒:能够直接在生命系统中测试数百万个结合剂设计。这使得平台能快速生成关于 biodistribution(生物分布)、cell‑type engagement(细胞类型参与)和 functional outcomes(功能结果)的 organism‑scale evidence,为模型训练和预测性设计提供了生物学相关的高质量标签数据。
mBER 的开发正是为了充分利用公司大规模 in vivo screening capabilities 的优势。作为 de novo 结合剂生成器,它能针对数千个靶点设计数百万个分子。mBER 在 Manifold 的战略布局中至关重要,它大规模产出高质量的设计假设,而 multiplexed in vivo readouts 则提供了高价值的验证标签。两者共同形成了前所未有的数据学习飞轮(flywheel),加速构建从药物设计到治疗效果的通用映射图(generalizable maps)。
mBER 的技术核心与创新优势
mBER 是一种蛋白质设计框架,它通过利用序列和结构信息对 AlphaFold-Multimer 进行条件化处理,从而实现所需抗体框架的结合剂设计。
mBER 的序列设计和优化,是通过反转 AlphaFold network 实现的——它迭代更新输入序列,直到 AlphaFold 对其与目标 epitope 结合的结构有高度置信度。
尽管 ColabDesign 和 BindCraft 等工具已在 backpropagation(反向传播)方面开创先河,但它们主要生成缺乏抗体可开发性优势的非受限“minibinders”。mBER 则实现了两大关键技术飞跃:
- 结构模板(Structural templates):确保设计严格遵循抗体架构。
- 序列先验(Sequence priors):利用来自 protein language models 的先验知识,使可变区序列更倾向于天然人源抗体序列。
通过这种结合,mBER 能够在不重新训练底层折叠模型的前提下,生成高度逼真且实验验证成功的抗体结合剂!研究发现,AlphaFold 的置信度指标,尤其是 ipTM,与实际实验的成功率高度一致。通过优化序列以匹配 AlphaFold 的高置信度指标,并过滤掉低置信度折叠的设计,mBER 在 de novo antibody binder design 方面实现了 state-of-the-art 的实验成功率。
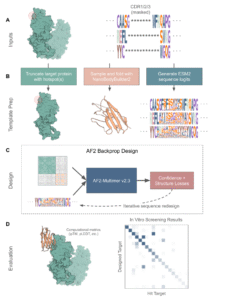
图片来源:Manifold Bio
一亿次相互作用:大规模验证凸显 ML2 潜力
为全面验证 mBER 并例证 ML2 平台的强大功能,Manifold 设计了超过一百万个针对436个人类受体(human receptors)的 VHH antibodies(VHH抗体),并在两组实验中进行了验证,总计测试了1,153,241个结合剂针对145个靶点。通过全对全(all-against-all)的测量,即同时测试设计抗体与其预期靶点和所有其他靶点,平台得以自信地验证其结合(binding)和特异性(specificity)。
这些实验共测量了超过 1亿次 抗体-靶点相互作用。最终,研究人员成功找到了近半数靶点(145个中的65个)的特异性结合剂,且在经过计算筛选后,在最佳 epitopes 上的成功率高达 40%。这标志着全球报道中规模最大的 de novo antibody validation campaign。
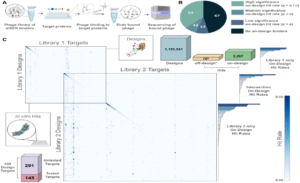
图片来源:Manifold Bio
战略愿景:解决生物医药界最严峻的挑战
Manifold Bio 打造 direct-to-vivo 和 mBER,旨在解决需要规模化解决方案的真实治疗挑战。
首个重点突破领域是血脑屏障(BBB)递送——这是一个巨大的挑战。目前的研究主要集中在利用单个受体 Transferrin Receptor (TfR),但其潜力和局限性正日益清晰。事实上,存在数百个可以促进分子进入大脑的“门户”(portals)。Manifold 凭借其独特的技术优势,能够系统性地搜索针对所有推定门户(putative portals)的分子穿梭(molecular shuttles)空间。mBER 通过生成庞大的精确设计库(vast libraries of precise designs),使这一宏伟目标成为可能,而 multiplexed in vivo platform 则能同时在生命系统中筛选所有候选药物。
此外,除了肝脏,数百种药物因组织特异性递送(tissue-specific delivery)的挑战而受阻。Manifold 正在向解决所有组织和细胞类型递送的宏伟使命迈进。为此,公司正在构建 EpiTome——一个专有数据资源,将 epitopes 与 in vivo biodistribution 关联起来,形成一个随时可用于开发药物的结合剂工具箱(toolbox of binders)。公司正扩展 mBER,以系统性地设计覆盖所有已知细胞表面受体 epitopes 的结合剂,并将其快速推进到 in vivo screens 中。
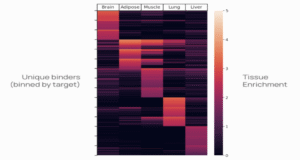
图片来源:Manifold Bio
mBER 和大规模筛选工作的另一个战略价值在于蛋白质结构数据语料库的扩展。公共数据库经过科学界数十年的努力,仅积累了数十万个结构。Manifold 通过生成数百万个合成结构,并进行大规模并行实验验证,正在快速构建一个丰富的、带标签的半合成结构数据集。这包括对难以(甚至不可能)在体外表达的靶点结合剂的 direct-to-vivo 验证。我们相信,这类数据将成为下一代蛋白质折叠模型训练的主要输入来源,驱动“更好的模型生成更好的设计,更好的设计进一步增强数据生成能力”的良性循环。
药物发现的未来蓝图
mBER 与 multiplexed in vivo screening technologies 的协同作用,正在重新定义治疗药物的发现模式:
- Design at scale(大规模设计):数百万个具有 structural priors(结构先验)的 epitope-specific binders。
- Validation at scale(大规模验证):在少数几次实验中全部直接在 in vivo 进行测试。
- Learning at scale(大规模学习):绘制 EpiTome,并为生物学基础模型(foundation models of biology)提供强大驱动力。
这正是解决医学界最棘手问题的路径,从脑部递送开始,并逐步扩展到全身的组织靶向。
共同加速创新
Manifold Bio 选择开源 mBER,旨在通过社区力量加速行业进步。您可以:
- 使用(Use it):为您关注的靶点设计抗体
- 扩展(Extend it):贡献更优秀的先验(priors)、损失函数(losses)和评估方法
- 合作(Partner with us):共同开发靶向药物
mBER 和 EpiTome 仅仅是起点。我们的最终目标是构建可编程药物(programmable medicines)——即您可以指定组织、细胞类型和生物学效应,AI 就能直接设计出实现该目标的分子。这一未来需要海量的生物学数据、强大的模型和全新的药物发现战略。
Manifold已经是全球数据资源最丰富的机构之一,致力于构建下一代模型和测量技术,并且这一优势正在加速巩固。这一技术路径在生物医药管线CGT合作大会上被广泛讨论,被认为将为细胞与基因治疗领域的靶向递送难题提供全新的解决方案。
文章来源:Manifold Bio


