神经退行性疾病以认知衰退和运动障碍为主要临床特征,其共同病理终点是神经元的进行性丢失。生物医药产业大会了解到,尽管不同疾病在病理标志和致病驱动上各具特点,但“神经元为何死亡、由何种上游机制触发”始终是限制治疗策略开发的核心难题。过去几十年的 GWAS 研究已鉴定出多种遗传易感因素,为疾病机制研究和药物筛选提供了线索,但直接驱动神经元死亡的关键分子过程仍缺乏系统认知。
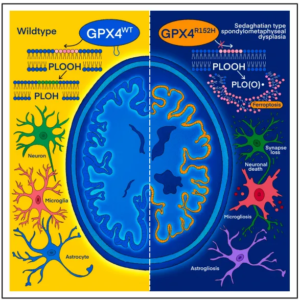
谷胱甘肽过氧化物酶 4(glutathione peroxidase 4,GPX4)是铁死亡(ferroptosis)的核心抑制因子。铁死亡是一种非凋亡性、铁依赖性的细胞死亡方式,与多种神经退行性疾病密切相关。临床上,GPX4 的致病性突变已被证实与极罕见的 Sedaghatian 型脊柱干骺端发育不良(SSMD)相关,该疾病以严重的神经退行性变和骨骼异常为特征,进一步凸显了铁死亡在神经系统稳态中的关键地位。然而,GPX4 如何在神经元中发挥抗铁死亡作用,其结构基础和细胞定位机制仍不清楚。

图片来源:BioArt
近日,德国亥姆霍兹中心代谢与细胞死亡研究所 Marcus Conrad 团队在 Cell 杂志发表题为 A fin-loop-like structure in GPX4 underlies neuroprotection from ferroptosis 的研究论文,通过对极罕见 SSMD 患者突变的系统解析,揭示了 GPX4 通过一种“鳍环状”疏水结构锚定细胞膜、发挥神经保护作用的关键分子机制。
罕见人类突变揭示关键结构线索
研究团队在来自两个不相关家庭的三名 SSMD 患者中,发现共同携带 GPX4 错义突变(c.455G>A;p.R152H)。影像学检查显示,这三名患者除典型骨骼异常外,还伴有不同程度的小脑萎缩。值得注意的是,神经退行性病变仅出现在纯合子突变个体中,且症状较双等位基因截断性 GPX4 突变患者更为温和,提示 R152H 突变并非完全功能缺失,而是揭示了一种此前未被认识的调控机制。
研究人员分离了纯合子患者及其杂合子父亲的原代成纤维细胞,发现仅纯合子来源细胞表现出典型的铁死亡特征,并可被自由基捕获剂或铁死亡抑制剂(liproxstatin-1)逆转。进一步将这些细胞重编程为人诱导多能干细胞(hiPSCs),并分化为大脑皮质神经元后,纯合子来源神经元同样出现铁死亡驱动的细胞死亡,直接证明该突变对神经元具有致病意义。
小鼠模型验证:R152H 为“亚效性”突变
为验证体内效应,作者构建了 Gpx4^R152H 小鼠模型。结果显示纯合子小鼠胚胎致死,提示人类患者中可能存在尚未明确的补偿或抑制机制。进一步在条件性模型中,他莫昔芬诱导后,小鼠出现与 GPX4 敲除高度相似的组织损伤,表明 R152H 变异无法在功能上补偿野生型 GPX4。
这些结果共同确认,R152H 是一种严重削弱但未完全废除 GPX4 功能的致病突变,其核心影响并非酶活性丧失,而是作用于更精细的结构和定位层面。
结构解析:鳍环状疏水结构决定膜结合能力
令人意外的是,后续实验发现 R152H 变异既不影响 GPX4 的转录和蛋白表达,也不削弱其催化活性。通过光谱学和晶体结构分析,研究人员发现野生型 GPX4 在约 130 位残基区域形成一个突出于蛋白表面的“鳍环状”疏水结构;而 R152H 突变会导致该结构塌陷,其余蛋白整体构象基本不变。
结合该区域显著的疏水性特征,作者提出这一鳍环结构可能介导 GPX4 与生物膜的相互作用。双分子层结合实验验证,R152H 突变显著削弱 GPX4 与膜的结合能力。进一步将鳍环附近的疏水残基(I129、L131)突变为亲水氨基酸,同样可抑制膜结合,而不破坏整体折叠,说明“疏水鳍环”是 GPX4 锚定膜结构的关键。
值得注意的是,用赖氨酸替代 R152(R152K)可通过水介导氢键部分恢复鳍环稳定性和功能,提示即便是有限的结构补偿,也足以维持 GPX4 抗铁死亡能力。
神经元特异模型:铁死亡驱动神经退行性变
在神经元特异性模型中,作者分别构建了前皮质谷氨酸能神经元和小脑浦肯野细胞特异性的 GPX4 缺失或 R152H 引入小鼠。结果显示,两种模型均出现进行性神经退行性病变,但 R152H 小鼠表型相对温和,呈现亚效性特征。
同时,血浆神经丝轻链(NfL)水平升高、小胶质细胞活化和免疫细胞浸润,进一步证明 GPX4 缺失或功能受损会引发广泛的神经炎症和轴突损伤。蛋白质组学分析还显示,GPX4 缺失神经元中阿尔茨海默病及其他神经退行性疾病相关通路显著富集,提示铁死亡与痴呆样分子特征之间存在紧密联系。
图片来源:BioArt
总结与产业启示
本研究以极罕见人类遗传突变为切入点,首次在结构层面阐明了 GPX4 通过“鳍环状疏水结构”锚定细胞膜、抑制脂质过氧化和铁死亡的分子基础,为理解神经元保护机制提供了关键证据。
生物医药产业大会认为,在神经退行性疾病与细胞死亡靶点领域,这一发现不仅强化了铁死亡作为治疗干预靶点的理论基础,也提示未来药物开发可从“增强 GPX4 膜定位或功能稳定性”这一全新角度切入,为神经退行性疾病的精准干预提供新的思路。
文章来源:BioArt


