
图片来源:医药速览
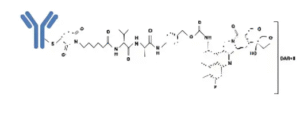
在全球创新药研究不断加速的背景下,2026生物医药产业合作大会聚焦前沿抗体偶联药物(ADC)研发趋势。近日,Molecular Cancer(影响因子33.9)刊发了耶鲁大学研究团队的最新成果,题为 “Harnessing ExDNA for precision exatecan delivery in cancer: a novel antibody-drug conjugate approach”。该研究提出了一种基于细胞外DNA(exDNA)与ENT2转运机制的新型ADC策略——V66-exatecan,为精准递送核靶向药物提供了新的解决思路。
图片来源:医药速览
传统ADC在临床中面临靶点局限、递送效率低和非特异性毒性等难题。耶鲁团队设计的V66-exatecan以高亲和力的抗exDNA人源化抗体V66为基础,通过可切割连接子与拓扑异构酶I抑制剂exatecan相连,实现了“exDNA识别 + ENT2转运 + 核定位打击”的协同机制。V66抗体首先识别肿瘤微环境中富集的exDNA,再通过ENT2进入肿瘤细胞核,从而在核层面精确释放药物,实现选择性杀伤。
图片来源:医药速览
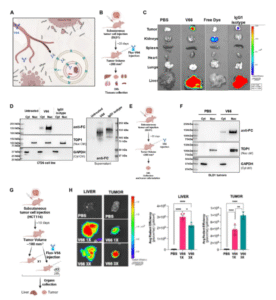
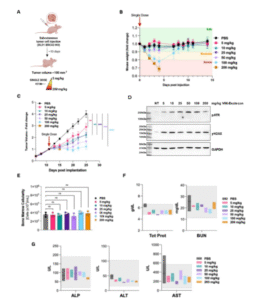
实验显示,荧光标记的V66抗体在携带DLD1肿瘤的小鼠模型中可高效富集于肿瘤组织,几乎不分布于健康组织,仅肝脏有少量摄取,显示其出色的靶向性和核定位能力。随后制备的V66-exatecan ADC保留了这一特性,并在多种癌细胞系中展现出低纳摩尔级的抗肿瘤活性,对正常细胞几乎无毒。
图片来源:医药速览
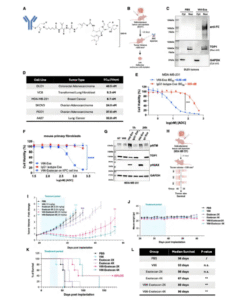
在BRCA2缺陷模型中,V66-exatecan的抗肿瘤活性显著增强——其EC50值比野生型细胞降低10至17倍;在体内实验中,V66-exatecan可显著抑制肿瘤生长、延长小鼠生存期,部分小鼠实现完全缓解。研究发现,BRCA2缺陷导致DNA修复受损、exDNA积累,从而增强了V66抗体的摄取效率。DNase I预处理可显著削弱V66摄取,而RNase I无影响,进一步验证了exDNA依赖机制。
图片来源:医药速览
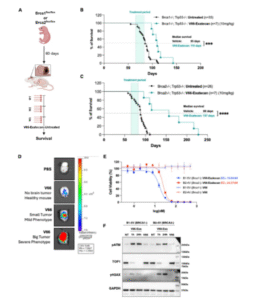
更具突破性的是,V66-exatecan能穿越血脑屏障,在BRCA1/2缺陷的髓母细胞瘤模型中实现脑内肿瘤定位与显著延命,显示其在中枢神经系统肿瘤中的应用潜力。在安全性方面,V66-exatecan在5–50 mg/kg剂量范围内表现出良好耐受性,血液学及肝肾功能指标稳定,仅在高剂量时出现轻微毒性。
图片来源:医药速览
研究总结表明,V66-exatecan在多种癌细胞系中展现出高效抗肿瘤活性和优良安全性,能诱导强烈的DNA损伤反应(DDR)信号及旁观者杀伤效应,对BRCA突变和中枢神经系统肿瘤尤为敏感。这一基于exDNA的ADC策略,为传统ADC的局限提供了全新解决方案,也为未来DDR缺陷型癌症治疗开辟了新方向。
伴随2026生物医药产业合作大会的行业聚焦,V66-exatecan的出现凸显了ADC技术与精准递送机制融合的最新趋势。该成果不仅展示了学术创新的临床潜力,也预示着未来抗肿瘤药物研发正向更智能、更精准的分子设计阶段迈进。
文章来源:医药速览


