ChinaBio生物医药投融资大会了解到2025年7月18日,国际权威期刊《Nature Cell Biology》发表了一项由中美科学家合作完成的重要研究,首次系统揭示了O-GlcNAc转移酶(OGT)作为活性氧(ROS)感应器调控铁死亡(Ferroptosis)的分子机制。这项研究为理解肝癌耐药性提供了全新视角,也为癌症治疗策略开发带来突破性启示。

图片来源:生物谷
一、铁死亡与ROS的核心关联
铁死亡是2012年发现的一种铁依赖性细胞程序性死亡方式,其特征是过氧化脂质异常堆积。在癌症发展中,铁死亡扮演着双重角色:既可抑制肿瘤生长,又可能因癌细胞逃避铁死亡而导致治疗耐药。活性氧(ROS)作为关键调控因子,通过脂质过氧化参与铁死亡启动,但其具体感知机制长期未明。
二、OGT作为ROS感应器的发现
研究团队通过肝细胞癌(HCC)模型发现:
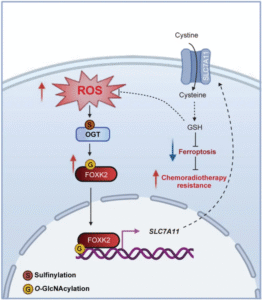
- 氧化激活机制:ROS诱导OGT催化结构域第845位半胱氨酸(C845)发生氧化修饰,显著提升该酶活性。
- 级联反应核心:激活的OGT催化转录因子FOXK2的O-GlcNAc糖基化修饰,这种翻译后修饰促进FOXK2与核转运蛋白α结合,加速其核转位。
- 下游调控网络:核内FOXK2特异性结合SLC7A11基因启动子区,上调该铁死亡抑制因子的表达,最终增强癌细胞对放化疗的抵抗。
三、OGT-FOXK2-SLC7A11轴的促癌作用
临床样本分析显示,该信号轴在肝癌中呈现显著激活状态:
- 通过维持细胞内氧化还原平衡,保护癌细胞免于铁死亡
- 促进肿瘤增殖和转移能力
- 导致传统化疗药物(如顺铂)和放疗敏感性下降
四、研究的转化医学价值
- 诊断标志物:OGT氧化水平或可作为肝癌耐药性预测指标
- 治疗靶点:针对C845位点的抑制剂设计可能阻断该通路
- 联合治疗策略:铁死亡诱导剂与现有放化疗联用有望克服耐药
图片来源:生物谷
五、O-GlcNAc糖基化的生物学意义
该研究同时深化了对蛋白质O-GlcNAc修饰的理解:
- 揭示了ROS与糖代谢的交叉调控
- 证实翻译后修饰在细胞命运决定中的枢纽作用
- 为其他ROS相关疾病(如神经退行性疾病)研究提供范式
这项突破性研究不仅阐明了”ROS-OGT-FOXK2-SLC7A11″分子轴的详细机制,更开创性地提出:靶向氧化-O-GlcNAc糖基化级联可能成为逆转癌症耐药的新策略。ChinaBio生物医药投融资大会认为未来研究可进一步探索:
- 该通路在其他癌症类型中的普适性
- 小分子化合物库筛选特异性抑制剂
- 基因编辑技术验证关键位点功能
文章来源:生物谷


