上海国际生物医药合作大会了解到,乳腺癌是全球女性癌症相关死亡的主要原因之一,尤其在绝经前女性中,内源性激素周期性波动对乳腺组织结构和细胞命运具有深远影响。长期研究表明,孕激素在乳腺上皮细胞增殖、分化及癌变过程中发挥关键调控作用:在月经周期黄体期,孕激素水平升高可通过旁分泌机制刺激乳腺管腔前体细胞扩增,而该细胞群被认为是三阴性乳腺癌等侵袭性亚型的重要潜在起源细胞。流行病学证据显示,长期使用含孕激素的避孕药或激素替代治疗与乳腺癌风险增加相关,动物模型研究亦证实,抑制孕激素受体或其下游信号通路可显著降低乳腺肿瘤发生率。然而,如何将这些基础发现转化为可行的人群预防策略,长期受限于缺乏能够反映风险真实下降的临床替代指标。作为目前已知最强的乳腺癌风险因素之一,乳腺密度与胶原蛋白排列方式、基质硬度及上皮—基质相互作用密切相关,提示孕激素可能通过重塑乳腺微环境的结构和力学特性,间接放大癌变风险。

图片来源:创药网
近期,英国曼彻斯特大学Sacha J. Howell团队在Nature在线发表题为 Anti-progestin therapy targets hallmarks of breast cancer risk 的研究成果,该研究所揭示的机制进展与上海国际生物医药合作大会关注的女性肿瘤预防方向高度契合。研究团队设计并实施了一项名为BC-APPS1的早期临床试验,系统评估抗孕激素药物乌利司他醋酸酯(ulipristal acetate,UA)在绝经前乳腺癌高风险女性中的短期预防效应。通过治疗前后配对的乳腺真空辅助活检样本,并结合多组学分析与影像学评估,研究发现为期12周的UA干预可显著改变乳腺组织的细胞和基质构成。结果表明,抗孕激素治疗能够通过激素依赖性的基质触发机制,重塑乳腺祖细胞所处的微环境,并伴随乳腺密度的下降,为乳腺癌化学预防提供了新的分子靶点和可量化的生物学依据。
BC-APPS1试验于2016年3月至2019年3月期间开展,共招募32名因家族史而具有较高乳腺癌风险的绝经前女性。经筛选后,26名受试者接受UA治疗,其中24人完成了基线及治疗12周后的配对活检,并被纳入最终分子反应分析。研究对象的中位年龄为39岁,中位剩余终生乳腺癌风险为25.5%。在整个干预过程中,UA总体耐受性良好,未观察到3级或4级不良事件,为后续深入解析其生物学效应提供了可靠且安全的临床基础。
在细胞功能层面,研究通过多维实验系统评估了抗孕激素治疗对乳腺上皮细胞亚群的影响。结果显示,UA治疗不仅显著降低了上皮细胞整体增殖水平,还特异性减少了管腔前体细胞的比例、增殖能力及其形成克隆和乳腺球的功能活性。鉴于管腔前体细胞被普遍认为是基底样、尤其是三阴性乳腺癌的重要起源细胞,对这一癌前细胞池的靶向削减,被认为是实现高风险人群精准预防的关键生物学基础。
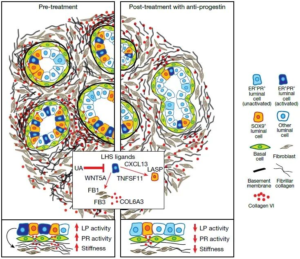
在分子机制层面,研究人员结合批量RNA测序、单细胞RNA测序(6对样本)、CellChat细胞通讯网络建模及NicheNet配体—靶基因分析,对抗孕激素治疗引发的转录组变化进行了系统解析。结果表明,管腔激素感应(LHS)细胞是治疗反应最为显著的细胞群,其分泌的孕激素相关配体谱发生明显改变。UA治疗削弱了基底细胞和成纤维细胞作为胶原信号主要来源的作用,并降低了所有细胞对胶原信号的整体接收能力。其中,来源于LHS细胞的WNT5A等配体被确定为下调人类成纤维细胞和基底细胞中COL6A3等关键胶原基因表达的重要候选因子,从而在整体上重塑乳腺基质组景观。这些结果揭示,抗孕激素治疗通过显著改变细胞间通讯网络,引发基质组成和结构的系统性重编程。
在空间与蛋白层面,研究团队进一步结合激光捕获显微切割蛋白质组学、成像质谱流式细胞术以及单细胞邻域分析,系统评估了UA治疗对乳腺基质的影响。结果显示,抗孕激素干预引发了显著的细胞外基质(ECM)重塑,其中胶原蛋白VI是下调幅度最为显著的成分之一,多条与ECM组织和胶原形成相关的通路同步受到抑制。空间定位分析发现,高表达SOX9的腔前体细胞(LASP)在治疗前后均稳定分布于胶原蛋白VI和纤连蛋白富集的微环境区域,提示腔前体细胞巢与特定基质成分之间存在紧密的空间依赖关系,而这一关系正是抗孕激素治疗早期干预的重要作用节点。
在功能验证层面,研究人员将高风险女性来源的乳腺微结构置于不同刚度的胶原模拟水凝胶中进行三维培养,并结合原子力显微镜测量组织力学特性、天狼星红染色评估胶原排列方式以及MRI分析纤维腺体体积(FGV)。结果表明,较硬的微环境可上调孕激素靶基因表达并增强管腔前体细胞活性;而抗孕激素治疗不仅阻断了这种由基质硬度驱动的异常激活,还在临床样本中显著降低了胶原纤维排列有序性、组织机械硬度以及影像学FGV。这些发现明确了基质硬度、孕激素信号与管腔前体细胞活性之间形成的正反馈回路,并证明抗孕激素疗法能够通过逆转这一回路,实现对乳腺癌风险的源头性干预。
图片来源:创药网
综上所述,该研究系统阐明了孕激素信号在塑造乳腺癌风险关键特征中的核心作用。孕激素通过旁分泌机制作用于腔前体/LASP细胞这一最易发生致癌转化的靶群体,并通过重塑基质结构与力学特性放大癌变潜能。BC-APPS1试验结果表明,抗孕激素治疗在乳腺癌高风险绝经前女性中具有明确的短期安全性和生物学有效性。UA可同步降低FGV、上皮细胞密度以及腔前体/LASP细胞的数量和功能活性,提示MRI检测的FGV(以及潜在的乳腺密度指标)有望成为评估抗孕激素预防效果的早期生物标志物。相关研究进展与上海国际生物医药合作大会所强调的“前移干预、精准预防”研究理念高度一致,为乳腺癌风险管理提供了具有转化价值的新范式。
文章来源:创药网


