在上海创新药管线交易合作大会持续关注的前沿技术版图中,蛋白质靶向降解(Targeted Protein Degradation, TPD)正从经典胞内靶点迈向更具挑战性的膜蛋白与胞外蛋白领域。作为细胞感知外界环境、介导信号转导并完成物质交换的分子基础,膜蛋白与胞外蛋白约占人类蛋白质编码基因的40%,且接近60%的已上市药物直接靶向这一类蛋白。它们在肿瘤、免疫、代谢及神经系统疾病中发挥核心作用,是创新药研发中最重要、同时也是最复杂的靶标来源之一。
传统小分子或抗体药物主要通过“功能抑制”模式干预靶点活性,不仅难以应对缺乏明确活性口袋的“不可成药”蛋白,还往往需要持续高剂量占位,存在脱靶毒性和耐药风险。以PROTAC、分子胶为代表的蛋白质靶向降解技术,通过诱导靶蛋白进入泛素-蛋白酶体系统,实现对蛋白本体的选择性清除,在不依赖功能位点结合的前提下提供了全新的干预逻辑。然而,受限于蛋白酶体主要分布于胞内,这类经典TPD策略长期只能作用于胞内蛋白,难以触及位于细胞膜或分泌至胞外空间的关键靶点。

图片来源:深圳湾实验室
正是在这一背景下,膜蛋白与胞外蛋白的靶向降解技术(meTPD, transmembrane and extracellular targeted protein degradation)应运而生,成为上海创新药管线交易合作大会所高度关注的技术突破方向之一。2025年11月27日,深圳湾实验室化学生物学研究所陈鹏团队在 Science 杂志发表题为 Targeted protein degradation in the transmembrane and extracellular space 的综述文章,系统梳理了该领域的核心机制、代表性技术平台及关键瓶颈,并提出以共价化学、多特异性设计、条件激活以及“降解—递送”融合为代表的新策略,将推动该领域从概念验证走向临床转化。与此同时,首个相关候选药物已进入临床阶段,标志着meTPD正逐步迈入实际应用窗口。
与经典TPD不同,meTPD并非简单延伸胞内降解逻辑,而是深度整合了靶蛋白识别与胞内转运机制。其核心思想并非让药物进入细胞寻找靶点,而是借助细胞天然的内吞—溶酶体途径,将膜蛋白或胞外蛋白“牵引”进入细胞,并在溶酶体中完成降解。通过双功能或多功能分子设计,一端特异性结合靶蛋白,另一端触发内吞与溶酶体分选,meTPD实现了从“抑制”到“清除”的范式转变,为癌症、自身免疫疾病等领域提供了新的治疗思路。
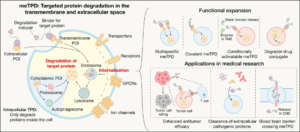
图片来源:深圳湾实验室
在该领域的早期探索中,LYTAC与AbTAC是具有代表性的策略,分别利用细胞表面的CI-M6PR受体或E3泛素连接酶RNF43,引导靶膜蛋白进入溶酶体降解。然而,这两类方法依赖特定受体或酶的表达,降解效率受细胞类型限制,通用性不足。针对这一关键瓶颈,陈鹏团队于2021年提出了“GlueTAC”策略,实现了受体或酶非依赖的通用膜蛋白靶向降解(J. Am. Chem. Soc., 2021)。
GlueTAC策略的核心在于将共价靶蛋白捕获与受体非依赖的内吞机制相结合。研究团队利用穿膜肽(CPP)与溶酶体分选序列(LSS)融合,构建了高效的内吞与溶酶体靶向模块CPP-LSS;同时借助遗传密码子拓展技术,在PD-L1纳米抗体中定点引入含磺酰氟基团的非天然氨基酸,构建具有共价结合能力的“胶水抗体”(Gluebody)。通过硫氟交换反应(SuFEx),Gluebody可与PD-L1形成不可逆共价连接,避免内吞过程中因解离导致的降解效率下降。最终,将Gluebody与CPP-LSS连接形成的共价纳米抗体嵌合体GlueTAC,在多种肿瘤细胞中实现了PD-L1的快速内吞与溶酶体降解,并在异种移植小鼠模型中展现出强于已获批PD-L1单抗的抑瘤效果。
图片来源:深圳湾实验室
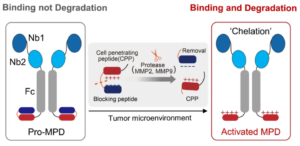
在向临床转化迈进的过程中,“On-target, off-tumor”风险成为meTPD必须面对的重要挑战。针对肿瘤相关抗原在正常组织中低水平表达可能引发的副作用问题,陈鹏团队于2024年提出了肿瘤微环境激活型降解策略Pro-MPD(J. Am. Chem. Soc., 2024)。该策略通过可被肿瘤相关蛋白酶切割的遮蔽结构,使穿膜肽仅在肿瘤微环境中被激活,从而触发靶蛋白内吞与降解;在正常组织中,降解嵌合体仅结合靶点而不启动降解,有效提升了空间特异性。Pro-MPD还引入双表位双特异性纳米抗体以增强亲和力,并采用非阻断型PD-L1抗体,使其抗肿瘤效应完全依赖于靶蛋白降解本身。在小鼠模型中,Pro-MPD实现了与商业化PD-L1阻断抗体相当的抑瘤效果,同时显著改善了肿瘤免疫浸润。
图片来源:深圳湾实验室
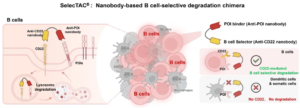
从GlueTAC到Pro-MPD,再到SelecTACB,这一系列工作系统性解决了meTPD领域的关键问题:通过共价交联提升靶标捕获与降解效率,通过微环境响应设计控制脱靶风险,通过特定受体策略赋予细胞选择性。这些研究不仅拓展了蛋白质靶向降解的空间边界,也为面向膜蛋白和胞外蛋白的下一代精准治疗策略奠定了坚实基础。
该综述由深圳湾实验室张衡副研究员与陈鹏研究员共同通讯,祝融峰副研究员为第一作者,相关研究得到深圳湾实验室重大项目资助。随着meTPD技术体系逐步成熟并向临床推进,其在创新药管线中的战略价值日益凸显,也正成为上海创新药管线交易合作大会所重点关注的潜在重磅技术方向之一。
文章来源:深圳湾实验室


