上海国际生物医药合作大会关注到,在前沿技术板块中,AI 优化、表观遗传调控与 LNP 递送体系的协同应用成为重要研究方向之一。围绕这一趋势,南方科技大学朱健康院士团队近期展示了基于 CRISPR 表观遗传编辑的长期基因沉默策略,进一步推动基因治疗从传统 DSB 方式向可逆、安全、长效的路径演进。
CRISPR/Cas 系统已进入多个临床试验,但第一代编辑工具依赖 DNA 双链断裂(DSB),可能造成染色体重排、大片段缺失或 p53 激活,其潜在安全性问题推动新一代无 DSB、高可控编辑工具的开发。表观遗传调控提供了无需改变 DNA 序列即可关闭基因的解决方案,更契合当前对安全可逆编辑技术的需求。
图片来源:RNAScript
研究团队在The Innovation 期刊在线发表论文“mRNA-engineered CRISPR-Cas epigenetic editors enable durable and efficient gene silencing in vivo”,通过脂质纳米颗粒(LNP)首次实现对体积巨大的 CRISPR OFF-EE 表观遗传编辑器 mRNA 的高效体内递送,使单次注射在小鼠体内维持长达 180 天的 PCSK9 基因沉默效果。该策略能够显著降低与高脂血症相关的 PCSK9 蛋白,呈现出“一次注射、半年持续”的特征。
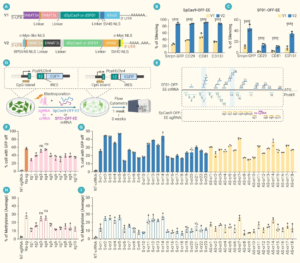
研究中的首个关键工程化难点是 CRISPR 表观编辑器(dCas9 或 dSF01 与抑制结构域融合体)的巨大尺寸。团队引入 AI 辅助设计,对编码 dCas-OFF-EE 的 mRNA 进行深度结构重构,包括:
1)密码子优化(Codon Optimization):提高表达紧凑度与翻译效率;
2)UTR 工程化(UTR Engineering):调控稳定性与表达动力学。
经 AI 优化形成的 OFF-EE V2 mRNA 是迄今最紧凑与高表达的表观遗传编辑器构建之一,可实现高效基因沉默。
图片来源:RNAScript
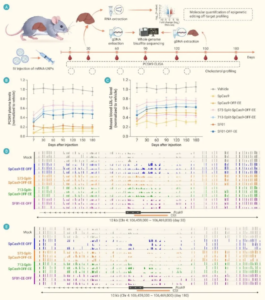
基于 LNP 递送的 mRNA 不会长期滞留细胞内,可避免 AAV 等病毒载体的免疫原性与潜在 DNA 整合风险,但也往往需要频繁给药维持药效。本研究中,瞬时表达的 OFF-EE V2 mRNA 诱导了稳定的表观遗传修饰,维持 Pcsk9 启动子区域的高甲基化状态,从而实现持续 180 天的基因关闭。
图片来源:RNAScript
为验证编辑效果,团队选择心血管代谢疾病的重要靶点 PCSK9。单次注射 LNP 包裹的 OFF-EE V2 mRNA 与靶向 PCSK9 的 sgRNA/crRNA,可抑制体内 PCSK9 水平高达 92.5%,LDL-C 降低 61.7%,药效持续至少半年,首次实现瞬态表达诱导的超长期基因沉默。该成果显著突破传统 RNA 药物作用时间短的限制。
安全性评估显示,小鼠血液学指标(ALT、AST、肌酐等)正常,组织切片未见炎症或细胞损伤;转录组测序证实仅靶基因表达下调,无显著脱靶效应。基于团队自主开发的 Cas12i 变体 CasSF01 的 SF01-OFF-EE 表观编辑器相较 SpCas9-OFF-EE 具备更高特异性,脱靶甲基化极少,为未来应用提供更稳健的安全边界。
该研究整合 AI 优化 mRNA、LNP 递送体系以及 CRISPR 表观遗传编辑三大技术方向,为可逆、安全、长效的基因调控提供新范式,也展示了慢病治疗从长期用药向“单次给药、长期控制”迈进的可能性。其技术组合方向与上海国际生物医药合作大会所关注的创新药物递送、新型编辑系统及慢病长期疗法路径高度契合。
文章来源:RNAScript


