生物医药产业大会关注到,Science近日发表了一项关于STING(Stimulator of Interferon Genes)激动剂耐受机制的重要研究,为免疫疗法开发困境提供新的解释和应对策略。STING通路作为机体识别胞质DNA、激发Ⅰ型干扰素反应的关键枢纽,曾被寄予重塑“免疫冷肿瘤”的厚望。然而,相关激动剂在临床上表现不佳,经常难以激活人体抗肿瘤免疫反应,引发研究界持续关注。
研究团队注意到,人类肿瘤中普遍存在的一种代谢缺陷——MTAP(methylthioadenosine phosphorylase)基因缺失——可能是关键原因。该基因位于染色体9p21.3区域,与经典抑癌基因CDKN2A/CDKN2B毗邻,常在多种实体瘤中同型纯合缺失,而这种缺失在实验用小鼠肿瘤模型中却极为罕见。这一差异提示,人类肿瘤可能存在一种未被动物模型捕捉到的免疫代谢障碍,从而导致对STING激动剂的天然耐受。
为了验证这一关联,中国医药大学(中国台湾)癌症生物学与精准治疗中心的 Mien-Chie Hung(洪明奇)领衔展开了系统研究。他们的成果以题为 MTAP deficiency confers resistance to cytosolic nucleic acid sensing and STING agonists 发表于Science(2025年10月9日)。研究团队综合运用了生物信息学分析、同源细胞模型、代谢检测、表观修饰验证、蛋白稳态调控及动物实验等多层次手段,逐步揭示了MTAP缺失引发的代谢-表观-免疫交叉机制,为临床免疫治疗领域提供了重要的分子机制解释与潜在干预策略。

图片来源;BioArt
研究团队构建了MTAP缺失与正常配对的同源细胞系,观察其对多种胞质核酸类刺激物(如poly(dA:dT)、poly(I:C)、天然STING配体2′,3′-cGAMP)的反应。实验结果表明,MTAP缺失会显著抑制Ⅰ型干扰素及其下游干扰素刺激基因的表达,关键原因在于IRF3蛋白水平的降低。
进一步机制解析显示,MTAP缺失导致代谢物甲硫腺苷(MTA)积累,从而抑制蛋白精氨酸甲基转移酶PRMT5活性,引发E3泛素连接酶MID1上调,最终促进IRF3蛋白降解。由此,一个清晰的分子链条被建立起来:MTAP缺失→MTA积累→PRMT5抑制→MID1上调→IRF3降解→STING通路失活。值得注意的是,MTA可由肿瘤细胞分泌至微环境中,进一步抑制邻近免疫细胞的核酸感应能力,加重免疫抑制状态。
在干预方面,研究团队尝试使用FDA已批准的小分子代谢调节剂DFMO,通过阻断多胺生成减少MTA堆积。实验中,联合使用DFMO能够成功恢复PRMT5活性、提高IRF3水平,并重新激活STING通路反应。特别是在免疫完整小鼠模型中,联合治疗显著改善了STING激动剂在MTAP缺失肿瘤中的抗肿瘤效果,并增强了CD8⁺T细胞浸润。
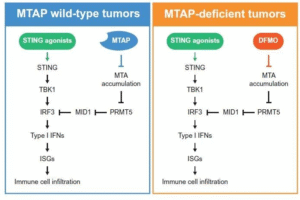
图片来源:BioArt
总体来看,研究团队通过系统的实验逻辑和多层验证清晰揭示了MTAP缺失会削弱细胞质核酸感应和STING通路,这一效应通过由MTA积累介导的PRMT5抑制及MID1上调引发IRF3降解的机制实现,可以通过DFMO药物有效干预逆转。该研究不仅为精准免疫治疗提供了切实可行的理论依据,而且揭示未来临床试验中应将MTAP状态列为关键生物标志物考虑。这一研究成果值得持续跟进,也将在生物医药产业大会等重要会议上持续引发业界深入讨论。
文章来源:BioArt


