在细胞免疫治疗领域, 2026创新药抗体&ADC合作大会持续关注新技术应用方向,特别是通用型细胞疗法的研发进展。近日,国际期刊《Cell Reports Medicine》刊发了一项来自浙江大学医学院附属第一医院骨髓移植中心、梁祝实验室以及启函生物(Qihan Biotech)等中国团队主导的研究,成功开发了靶向CD70的iPSC来源CAR-NK细胞(命名为“70CAR-iNK”)。该研究不仅解决了传统CAR-T疗法的制备周期长、成本高和GVHD风险等痛点,也为通用型免疫疗法奠定了坚实基础。

图片来源:干细胞与外泌体公众号
一、CAR-T时代的困局与CAR-NK的“上位”逻辑
作为免疫治疗领域的里程碑,CAR-T近年来在B细胞恶性肿瘤治疗上取得突破,尤其在R/R急性淋巴细胞白血病及DLBCL领域获批疗法不断增加。然而,CAR-T仍面临着适应症受限、自体细胞制备周期长、成本高达百万元人民币、实体瘤疗效有限等难题。相比之下,自体或异体来源的NK细胞具有更低的GVHD风险、更强的自然杀伤能力,同时无需HLA匹配,是具备“通用型”潜力的天然优选对象。
然而,传统NK细胞来源受限,体外扩增受肿瘤微环境抑制,难以满足规范化临床应用。诱导多能干细胞(iPSC)作为一种可无限自我更新、易进行基因编辑的细胞类型,为NK细胞疗法的“通用化”和规模化带来了可能。
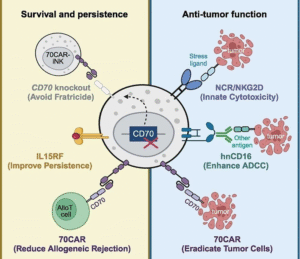
二、四项创新性基因编辑:70CAR-iNK的全链路优化设计
本次研究的核心创新在于通过多基因精准编辑构建“杀瘤+抗排斥”双效合一的通用型CAR-NK细胞,设计亮点如下:
- 敲除CD70避免NK细胞“同类相残”
70CAR-iNK通过CRISPR敲除CD70基因,避免与自身表达靶点的CAR发生“自杀性攻击”,保持了扩增效率和细胞活性。 - 高亲和力非切割型CD16(hnCD16)增强抗体联动能力
在NK细胞表面导入hnCD16,可稳定识别肿瘤抗体如利妥昔单抗,实现ADCC功能,且不被活化后切割,提高联合抗体治疗的持久杀伤力。 - IL15RF自分泌生长因子模块提升生存与持久性
IL15RF将IL-15与其受体融合,使细胞内持续激活STAT3/5信号,实现无需外源因子即可维持体外存活与体内扩增。 - 靶向CD70的CAR模块赋予精准肿瘤识别能力
基于CD70在淋巴瘤、肾癌、白血病等肿瘤中的高表达特点,该CAR设计使70CAR-iNK在多癌种实体瘤中具备靶点特异杀伤性能。
图片来源:干细胞与外泌体公众号
三、实验数据:70CAR-iNK展现强效、双线、多癌种杀伤表现
实验数据显示,70CAR-iNK在体外及动物模型中均展现出明显优势:
- 多目标覆盖:对淋巴瘤、白血病、骨髓瘤、肾癌、乳腺癌等12种细胞系均呈现显著杀伤活性,即便低表达天然杀伤配体者,也能通过CAR精准对靶。
- 复合免疫机制输出:除CAR机制外,hnCD16介导的抗体联动显著提升针对CD20肿瘤的协同效应。
- 体内存活时间延长50%+:其长期扩增性显著优于传统NK细胞。
- 免疫耐受优势:在异体排斥模型中可反杀活化的异体T细胞(alloT),长期存留超过28天。
四、临床转化与未来展望
70CAR-iNK具备以下潜在优势:
- 标准化与规模化:iPSC来源,支持批量化交付,多患者通用。
- 更高安全阈值:规避GVHD风险,低靶点背景表达降低脱靶可能。
- 多模态联用能力:可与抗体药物、抑制剂、放疗等进行组合策略增强疗效。
研究团队目前正进入临床前GLP验证,未来计划在淋巴瘤与肾癌适应症中开展I期临床试验,为国际临床推进通用免疫治疗提供“中国方案”。
预计该成果将在未来的临床转化中引发更多关注,也将成为2026创新药抗体&ADC合作大会上细胞免疫板块的重要亮点之一。
文章来源:干细胞与外泌体公众号


