ChinaBio创新药大会关注到,美国宾夕法尼亚州立大学 Santhosh Girirajan 课题组在《细胞》(Cell)上发表的重磅研究论文Genetic modifiers and ascertainment drive variable expressivity of complex disorders。该研究通过深入解析主要与次要基因变异的复杂交互作用,为理解复杂疾病的表型多样性和“multi-hit”模型提供了系统框架。

图片来源:BioArt
一、 挑战与模型:复杂疾病的异质性难题
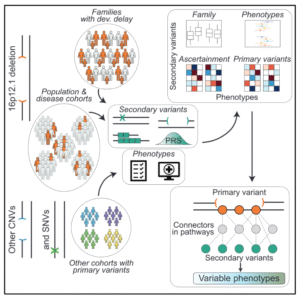
随着大规模基因组测序的深入,科学界逐渐认识到基因变异与遗传疾病间的关系远比孟德尔病复杂。许多复杂疾病(如发育迟缓、自闭症谱系障碍等)表现出显著的表型异质性:同一致病变异在不同个体中可能导致程度或类型各异的症状。这种差异主要源于多遗传因素的叠加,即个体同时携带多个致病变异或受修饰变异(modifier variants)影响。
研究者提出了“multi-hit”模型:主要致病变异(First Hit)赋予个体疾病易感性,而其他稀有或常见变异(Secondary Variants)则决定最终的临床表现。然而,次要变异具体如何影响原发性变异的临床特征,一直是遗传学和临床转化的关键难点。
二、 核心发现:遗传负荷的跨代累积与 16p12.1 缺失解析
为系统研究这种可变外显性(variable expressivity),Girirajan 课题组选取了复发性拷贝数变异 16p12.1 缺失作为理想模型。该缺失通常遗传自父母,但临床表型高度可变。
研究团队对 124 个家系(共 442 人,主要包括发育迟缓患儿)的表型与基因组数据进行了系统整理和比对,取得了以下关键成果:
- 患儿表型严重性增加:相比携带相同缺失的父母,患儿的表型更为严重,发育迟缓现象显著。高达 93% 的患儿缺失为遗传性。
- 次要变异负荷叠加:约三分之一的患儿同时携带有可独立致病的次要变异,包括已知致病的 CNV 或功能缺失型变异(LoF)等。
- 负荷跨代递增趋势:患儿比父母携带更多受约束基因的错义/LoF 变异,且三代家系分析清晰显示变异负荷与表型严重度呈跨代递增趋势。
- 功能通路富集:这些次要变异富集于脑表达、突触后致密区高表达,以及受进化约束的基因,并与 1 区域基因在神经前体细胞中的共表达模块紧密相关。
结论证实: 16p12.1 缺失患儿的重症表型是家系内累积的多类次要变异共同作用的结果,强力支持了复杂疾病的 “multi-hit”模型。
图片来源:BioArt
三、 创新机制:蛋白网络中的个体化和表型特异性
为探究不同次要变异如何通过不同机制产生各异的临床表型,研究团队引入了蛋白互作网络(STRING)分析。
- 通路差异化:研究发现 1 内的各基因(及其通往次要变异的通路)共享连接很少,暗示它们倾向于扰动彼此不同的功能通路,解释了表型的多样性。
- 关联特异性:通过回归模型,作者总结了变异类别与特定表型域的关联,例如罕见编码变异与神经系统/生长特征相关,LoF 与头围减小相关。
- 个体化特征:这一发现强调,1 区域的多元功能使其易与次要变异互作,但具体变异的调动和通路选择是个体化且表型特异的。
四、 普适性与临床转化意义
该研究还解答了致病缺失在疾病队列和健康人群(如 UK Biobank)中表现差异巨大的原因,发现这与样本筛选方式(ascertainment)和次要遗传变异负荷密切相关,即保持健康往往需要较低的遗传负荷。
将研究推广至其他主要变异后,核心规律依然成立:次要变异的效应高度依赖于主要变异的存在,明确证实了主要变异作为“first hit”的触发作用。
总结而言: 这项工作系统阐明了复杂疾病中 “multi-hit”模型的遗传机制,揭示了主要变异增加易感性,而次要变异决定最终临床严重程度和类型。该研究为理解可变外显性的分子基础提供了系统且可落地的框架。我们期待这些发现能转化为新的诊断和治疗靶点,推动ChinaBio创新药大会的合作与突破。
文章来源:BioArt


