圆满落幕的ChinaBio合作大会 注意到,5月21日,国家药品监督管理局(NMPA)官网公示,诺诚健华引进的CD19人源化单克隆抗体「坦昔妥单抗」(Tafasitamab)正式获批,用于与来那度胺联合治疗不适合自体干细胞移植的复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)成人患者。该适应症此前已被纳入优先审批通道,加速上市进程。
![]()
截图来源:NMPA 官网
药物机制与全球研发历程
坦昔妥单抗是一款靶向CD19抗原的创新抗体,其Fc结构域经Xencor公司独家工程化改造,显著增强抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP),通过诱导肿瘤细胞凋亡及激活免疫效应机制清除B细胞肿瘤。
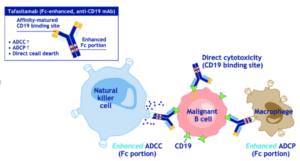
截图来自:Expert Opinion on Biological Therapy
该药物的全球开发历程始于MorphoSys公司:2010年,MorphoSys从Xencor获得全球独家开发权;2020年与Incyte达成全球合作协议,后者于2024年获得独家商业化权利。2021年,诺诚健华与Incyte签署协议,获得坦昔妥单抗在大中华区血液肿瘤及实体瘤领域的开发与独家商业化资格。此前,该药已先后于2020年和2021年获FDA和EMA批准用于DLBCL二线治疗,并于2022年在中国启动临床研究,2024年提交上市申请并获受理。
截图来自:Insight 数据库
关键II期研究数据与临床价值
在2024年欧洲血液学会(EHA)会议上,诺诚健华公布了坦昔妥单抗联合来那度胺治疗复发/难治性DLBCL的II期研究(NCT05552937)结果。这项单臂、多中心研究显示,该联合疗法在中国患者中展现良好耐受性,疗效特征与国际多中心L-MIND研究基本一致。
数据截至2024年1月29日,独立评审委员会(IRC)评估的客观缓解率(ORR)为73.1%,其中完全缓解(CR)率32.7%,部分缓解(PR)率40.4%;研究者评估的ORR为69.2%,CR与PR率均为34.6%。
市场竞争与适应症突破
目前全球范围内活跃的CD19单抗管线共7条,其中仅诺诚健华的坦昔妥单抗和豪森药业引进的伊奈利珠单抗获批上市。值得注意的是,伊奈利珠单抗主要用于视神经脊髓炎等自身免疫性疾病,而坦昔妥单抗是首款获批肿瘤适应症的CD19单抗,填补了该靶点在血液肿瘤治疗领域的空白。

截图来自:Insight 数据库


