近日,生物医药产业大会关注到,2026年1月2日,国际顶级期刊PNAS刊发了中国科学院精密测量院超灵敏磁共振研究团队的重磅成果——一款名为氟化脂质纳米颗粒(FLNP)的新型递送系统横空出世。该系统通过创新性引入氟化化学修饰,不仅破解了传统mRNA递送载体的效率与毒性难题,更首次实现了mRNA体内递送过程的实时、非侵入性量化追踪,为全球mRNA疗法研发开辟了“可视化”新路径。
在后疫情时代,mRNA技术已成为传染病预防与肿瘤免疫治疗的核心赛道,而脂质纳米颗粒(LNPs)作为mRNA递送的主流平台,虽具备优异的核酸包封与胞质释放能力,却长期受困于三大瓶颈:肝脏蓄积引发的系统性毒性、靶向转染效率不足,以及递送与免疫反应之间的“黑箱”认知缺失——传统研究仅能通过终点实验推断LNP体内命运,无法实时捕捉递送全过程。中科院团队的这项研究,正是针对这些行业痛点的精准突破。

图片来源:RNAScript
氟化修饰赋能:结构稳定与功能升级兼得
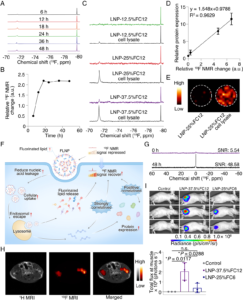
研究团队设计合成了两种含氟脂质分子FC12与FC6,二者均搭载可质子化的仲胺头基,能在生理pH环境下通过静电作用与带负电的核酸紧密结合,同时自带强而稳定的19F信号,为磁共振成像(MRI/NMR)提供了天然的可成像标签。两种脂质的核心差异在于疏水链长度:FC12拥有12个碳原子的长链,FC6则为6个,这一设计导致二者在脂双层中呈现不同排列密度。
生物医药产业大会了解到在FLNP制备过程中,研究人员以25%或37.5%的氟化脂质替代传统LNP中的SM102。冷冻电镜(Cryo-EM)与动态光散射(DLS)检测显示,FLNP保持了与临床级LNP相似的致密球状结构,平均直径稳定在100nm左右,证明氟化改造未破坏载体核心形态。更关键的是,其包封效率并未受损,25% FC12配方的包封率达到82.5%,与传统LNP水平相当,实现了“功能添加不牺牲基础性能”的设计目标。
体外实验亮眼:递送效率最高提升14倍
体外细胞实验中,FLNP的递送性能展现出显著优势。在293T细胞模型中,25% FC12配方的FLNP递送EGFP(增强型绿色荧光蛋白)的效率较传统LNP提升7倍以上,37.5% FC12配方的提升幅度更是高达14倍。这一飞跃源于多重分子机制的协同作用:FC12的长链结构使脂双层排列更紧密,同时增强了载体的稳定性与流动性,不仅让细胞摄取量提升约1.7倍、内体逃逸效率提升约1.5倍,还能在胞吞早期更好地保护核酸,降低其被内体核酸酶降解的风险。
19F MRI突破:实时追踪+效率预判双功能
生物医药产业大会了解到,FLNP最具革命性的创新,在于其赋予的“自显影”能力。由于人体内几乎不存在内源性氟,19F磁共振技术具备极高的特异性和背景信噪比。研究团队发现了关键现象:当氟化脂质被封装在LNP中并结合核酸时,分子运动受限导致19F NMR信号显著衰减;而当LNP进入细胞并解体释放核酸后,氟化脂质恢复自由运动,磁共振信号随之“苏醒”。
基于这一特性,团队构建了实时追踪体系:293T细胞处理后48小时内,19F NMR信号恢复与核酸释放呈强线性相关;信号强度随处理时间延长持续增强,约18小时达到平台期,这一时间点明显早于EGFP蛋白表达峰值,意味着NMR信号可作为监测递送效率的早期指标。更具应用价值的是,信号恢复程度与最终转染效率的相关系数高达0.9629,研究者无需等待数十小时后的蛋白表达结果,即可通过体外磁共振信号强度精准预判载体的体内表达潜力,彻底改变了传统“注射-等待-优化”的盲目研发模式。
图片来源:RNAScript
体内表现惊艳:肝蓄积降低94.6%,安全性获验证
传统LNP疫苗的肝脏蓄积问题一直是制约其临床应用的关键瓶颈。而小鼠体内实验显示,25% FC12配方的FLNP在实现与临床级LNP相当的局部转染效率基础上,将肝脏中的表达量降低了94.6%,凸显了氟化结构在避免LNP被动进入肝脏的天然优势。同时,H&E染色结果证实,FLNP给药后肌肉组织未出现明显炎症损伤或病理改变,为其临床转化筑牢了安全性基础。
免疫机制新解:注射部位启动,APC介导抗原转运
长期以来,mRNA疫苗的免疫激活机制存在争议,核心疑问在于:是LNP直接引流至淋巴结,还是抗原在注射部位表达后被转运?借助FLNP的时空追踪能力,研究团队首次厘清了这一过程:注射后24小时,注射部位与腹股沟淋巴结(iLNs)均能检测到强烈的蛋白质表达,但19F NMR信号与mRNA定量PCR(qPCR)结果显示,绝大部分LNP和mRNA仍滞留于注射部位,且此处19F信号明显恢复。
后续实验证实,mRNA在注射部位局部表达生成抗原蛋白后,由注射部位的抗原呈递细胞(APCs)摄取并迁移至淋巴结,淋巴结内的CD169+巨噬细胞与EGFP信号高度共定位,明确了这一抗原运输链路。该发现推翻了“LNP直接进入淋巴结”的传统假设,证实mRNA疫苗的免疫启动点位于注射局部,而FLNP的成像能力让这一动态过程首次被直接观测到。
行业影响深远:从“经验试错”到“理性监测”的跨越
该研究由中科院精密测量院博士生解铠铷、博士后朱立军担任共同第一作者,研究员周欣、陈代钦为共同通讯作者,得到了科技部、国家自然科学基金委及中国科学院等项目的支持。尽管目前FLNP系统在通量筛选方面仍受限于磁共振设备灵敏度与氟信号重叠等技术挑战,但其为mRNA疗法带来的变革性价值已毋庸置疑。
未来,随着具有不同化学位移的多色谱氟化脂质的开发,科学家有望在单次实验中实现多种候选配方的并行监测。这种从“经验试错”到“理性监测”的范式转变,将大幅加速癌症、遗传病及新兴传染病领域的精准mRNA药物开发。FLNP早已超越了单纯的递送载体范畴,成为洞察生命大分子在复杂生物系统中动态行为的“可视化窗口”,为全球mRNA疗法的创新发展注入了强劲的中国力量。
文章来源:RNAScript


