引言
抗体偶联药物(ADC)作为肿瘤治疗领域的”智能导弹”,通过精巧的分子设计将单克隆抗体的靶向性与细胞毒素的杀伤力完美结合。自1990年代中期首款ADC进入临床试验以来,这一技术平台已成功催生15款上市药物,在血液肿瘤和实体瘤治疗中取得突破性进展。
然而,ADC的临床转化仍面临三重技术壁垒:靶抗原表达的时空异质性导致药物递送效率波动,肿瘤微环境诱导的耐药机制降低治疗效果,以及系统性毒性限制给药剂量。为突破这些瓶颈,科研界正通过四大创新维度重构ADC技术范式——在结构设计层面开发双表位靶向ADC提升肿瘤选择性,在载荷系统方面首创双机制毒素组合克服耐药,在智能控释领域构建微环境响应型条件激活ADC,在协同治疗方向探索与免疫检查点抑制剂、PROTAC技术的联合策略。这些突破性进展正在重新定义ADC药物的治疗边界,为晚期癌症患者带来更精准、更持久的临床获益。
一、双特异性ADC
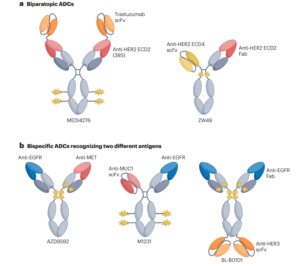
肿瘤异质性和耐药性通常限制针对单一靶点治疗的抗肿瘤活性。为了应对这一挑战,双特异性抗体是一种能够同时结合两种不同靶分子和/或细胞的方法。利用该技术的双特异性ADC作为增强抗肿瘤疗效的潜在途径成为上海生物医药技术大会的热点。迄今为止探索的设计可分为两种类型:针对同一抗原不同表位的双特异性ADC,以及靶向两种不同抗原的双特异性ADC。
图片来源:生物制药之家公众号
MEDI4276是一种将曲妥珠单抗的scFv与另一种抗HER2 IgG1抗体39S的N末端融合的四价HER2靶向ADC。MEDI4276在治疗难治性HER2+癌症的小鼠异种移植物模型中显示出显著的活性,但在临床测试时并未表现出良好的疗效-安全性平衡。在乳腺癌的患者中,总体有效率(ORR)较低(9.4%),最大耐受剂量(MTD)确定为0.75 mg/kg每3周一次。
ZW49是另一种靶向HER2双靶点的ADC,其不对称结构能够实现二价HER2结合。在测试ZW49的I期剂量发现研究中,建议的II期剂量(RP2D)为2.5 mg/kg,每3周一次。在该给药方案下接受ZW49治疗的29名可评价疗效的患者中,多种HER2+晚期癌症类型的确认ORR为28%,疾病控制率为72%。只有9%的患者出现≥3级治疗相关不良事件(TRAE),另有三名患者出现临床严重事件。这些结果表明,ZW49在经过大量预处理的患者中具有可控的安全性和良好的抗肿瘤活性。MEDIO276和ZW49都被设计用于识别HER2并促进受体聚集、内化和溶酶体运输。
AZD9592是阿斯利康开发的EGFR/c-Met ADC,通过可连接linker偶联新型拓扑异构酶1载荷,主要解决奥希替尼耐药。相较于EGFR,AZD9592 对 c-MET 具有更高的亲和力,目的是减少由EGFR驱动的正常组织毒性。在PDX及耐药模型中,单药或联用奥希替尼均展现出良好的抗肿瘤活性。
M1231是Sutro和默克子公司EMD Serono合作开发的MUC1/EGFR双抗ADC,采用非天然氨基酸定点偶联技术,通过可裂解VC连接子偶联hemiasterlin衍生物(微管抑制剂),DAR为4。临床前研究显示,在ESCC和NSCLC患者衍生的异种移植模型中具有很强的抗肿瘤活性。
BL-B01D1是中国首个进入I期临床的双抗ADC,靶向EGFR和HER3,接头采用其自有的Ac接头,相较于Mc接头具有更好的稳定性,亲水性更好,不易聚集;毒素为自有的喜树碱类似物ED04。其I期临床用药安全性较好,未出现药物相关的患者死亡情况。在安全性较好的10例可评估的NSCLC末线患者中,ORR为60%,DCR为90%。
二、条件激活ADC
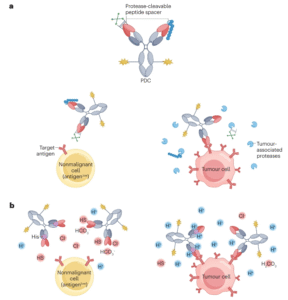
靶向受体的传统ADC不仅在肿瘤细胞上表达,而且在某些非恶性组织上表达,通常与不可避免的靶向非肿瘤毒性有关,导致剂量减少或治疗中断。为了解决这个问题,已经开发了以条件活性抗体为特征的新型ADC设计。
图片来源:生物制药之家公众号
这一设计概念的灵感来自小分子的前药设计,通过该设计赋予药物的药理学非活性形式,然后在循环或某些器官中代谢为其活性形式,从而提高体内稳定性和/或特异性。通过一种对多种蛋白酶敏感的可切割肽序列(LSGRSDNH),人们开发了几种条件激活的ADC,目前正在临床前和临床开发中,包括praluzatamab ravtansine(NCT03149549和NCT04596150)和CX-2029(NCT03543813)。
此外,人们还开发了具有pH响应性抗原结合位点的ADC。TME的酸性通常略高于大多数非恶性组织,由于抗原结合位点的可逆构象变化,这种pH差异可用于实现ADC的条件激活。迄今为止,已经开发了包括靶向EGFR、HER2、AXL和ROR2的各种pH依赖性ADC。在多种临床前小鼠异种移植物模型中显示出良好的抗肿瘤活性。
三、免疫激动ISAC
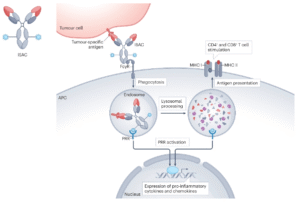
过去十年癌症免疫疗法的变革性进展,激发了人们对该领域的新兴趣。在由肿瘤细胞释放损伤相关分子模式(DAMP)触发的先天免疫激活的背景下,与模式-认知受体(PRRs)相互作用的免疫佐剂分子已成为癌症药物开发的焦点。在将PRR激动剂特异性递送至肿瘤的各种尝试中,与特异性PRR激动药的偶联抗体已成为一种有前途的先天免疫局部激活方法。
临床前研究已经证明,与携带细胞毒性有效载荷的传统ADC相比,ISAC具有独特的潜在优势:首先,ISAC介导的抗肿瘤反应可以靶向多种肿瘤相关的DAMP;其次,ISAC介导的免疫刺激最终不仅激活抗原呈递细胞(APC),而且可能激活其他肿瘤浸润免疫细胞,如T细胞;第三,ISACs在整个细胞免疫反应中引发免疫记忆效应,提供持久的抗肿瘤作用并降低复发风险。
图片来源:生物制药之家公众号
在迄今为止表征的所有TLR中,TLR7、TLR8和TLR9是迄今为止开发的大多数ISAC的主要靶标。抗HER2 TLR8 ISAC SBT6050即pertuzumab zuvotolimod,其由通过可裂解的连接子与pertuzumab偶联的TLR8激动剂组成。在I期研究(NCT04460456)中,其作为单一疗法与抗PD-1抗体pembrolizumab或cemiplimab组合进行测试;在I/II期研究(NCT05091528)中与其他HER2靶向疗法组合进行测试。但由于细胞因子相关的不良事件以及缺乏足够的单药活性,最终导致这些研究终止。免疫激动型ISAC的药效和安全性仍有待临床的进一步检验。
四、基于PROTAC的DAC
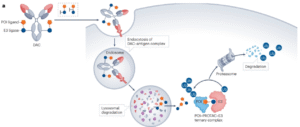
DAC携带蛋白水解靶向嵌合体(PROTAC)而不是传统的细胞毒性有效载荷,是一类新的靶向疗法。DAC形式有可能进一步提高这种新模式的临床实用性,通过利用基于抗体的药物递送的能力提供高水平的肿瘤特异性和持久活性。
图片来源:生物制药之家公众号
DAC的单克隆抗体部分识别肿瘤相关抗原,触发DAC-抗原复合物的内化。连接子在蛋白水解、酸性和/或还原条件下降解,从而将结合的PROTAC分子释放到细胞质中。通过E3连接酶的参与导致感兴趣的蛋白质(POI)泛素化,从而导致POI的降解。一些DAC正处于早期临床开发阶段,如靶向含溴结构域蛋白4(BRD4)的DAC正在为CLL1+急性髓细胞白血病(AML)患者中进行测试;以及靶向G1至S相变1蛋白(GSPT1)的ORM-5029,该DAC目前正在HER2+乳腺癌症患者中测试(NCT05511844)。
五、双载荷ADC
大多数实体瘤由异质性癌细胞亚群组成,具有不同的基因表达谱和对药物的敏感性水平,具有不同作用机制。因此,临床实践中通常采用涉及具有不同作用模式的多种药物的联合方案。双有效载荷ADC有可能作为单一药物引发相加或协同效应,并在维持简单给药范围的同时克服治疗难治性肿瘤患者的耐药性。
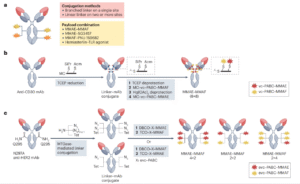
图片来源:生物制药之家公众号
2017年报道了一种使用含有两个正交掩蔽的半胱氨酸残基的支链化学连接子生产双载荷ADC的方法。通过顺序偶联有效载荷能够以16的DAR将MMAE和MMAF均匀偶联到抗CD30抗体上。这种双载荷ADC在表达CD30+MDR-的间变性大细胞淋巴瘤(ALCL)的小鼠异种移植物模型中显示出强大的活性。
除了具有MMAE和MMAF有效载荷的ADC之外,随着结合两种不同有效载荷类别的ADC的开发,双载荷ADC的临床潜力得到了进一步探索。如asterlin加上与抗FolRα抗体偶联的TLR激动剂的组合,其在小鼠模型中显示出协同抗肿瘤活性和免疫记忆。目前,双载荷ADC潜力的研究仍处于探索的早期阶段。
结语
抗体偶联药物(ADC)展现出广阔的治疗前景,但其临床应用仍面临多重挑战。当前研发需重点突破三大瓶颈:肿瘤耐药性机制、病灶异质性(包括瘤内和瘤间差异)以及治疗相关不良事件(TRAE)的控制。针对这些挑战,新一代ADC技术正通过三大创新路径实现突破:双特异性抗体设计可同时靶向多个肿瘤抗原,双载荷技术能协同发挥不同机制的抗癌作用,而条件激活型ADC则通过肿瘤微环境响应性释放有效提升治疗精准度。更值得上海生物医药技术大会关注的是,ADC与其他治疗模式的联合策略正在开辟癌症治疗新范式——通过与免疫调节剂联用、靶向蛋白降解技术结合,或将重塑化疗、放疗及靶向治疗的传统格局,为难治性肿瘤提供多维度解决方案。
参考资料:Targeting neutrophils for cancer therapy. Nat Rev Drug Discov. 2025 May 15
文章来源:生物制药之家公众号


