近日,生物医药产业大会关注到,靶向CD19的嵌合抗原受体(CAR)T细胞疗法在复发或难治性B细胞急性淋巴细胞白血病(B-ALL)的治疗中展现出显著的缓解效果,但复发问题仍未得到彻底解决。据临床数据显示,约半数患者在接受该治疗后会出现疾病复发,且复发患者的预后极差。因此,寻找能够有效预测复发风险的生物标志物,进而指导临床制定针对性的复发预防策略,成为当前该领域的研究重点。
B细胞缺乏(BCA)是CD19-CAR T细胞治疗后的一种常见肿瘤外靶向效应,其持续存在状态可作为评估CAR T细胞功能性存续的替代生物标志物。相较于直接检测CAR T细胞,BCA监测更具临床可行性——直接检测CAR T细胞不仅操作复杂,且即便检测到其存在,也无法直接证明其仍具备功能性,而这种功能性对于维持患者长期缓解、实现有效免疫监视至关重要,这一点在B-ALL患者中尤为突出。
临床研究发现,CAR T细胞输注后6个月内出现的早期B细胞恢复(BCR),可作为CAR T细胞功能性丧失的信号,且与B-ALL患者的复发风险密切相关。尽管目前尚未明确BCA的最佳持续时长,但ELIANA与ENSIGN两项临床试验的汇总数据显示,BCR出现的时间越早,患者发生CD19阳性复发的概率越高:在治疗后3个月出现BCR的患者,其2年无事件生存率(EFS)仅为9%;而6个月时出现BCR的患者,该指标也仅提升至14%。基于这一发现,部分临床医生建议对早期出现BCR的患者采取强化治疗措施,包括巩固性异基因造血干细胞移植、CAR T细胞再次输注或维持性化疗等。

图片来源:细胞知聊
然而,长期以来,不同研究机构和临床中心在B细胞缺乏与恢复的判定标准上存在显著差异。在检测阈值方面,有的中心以外周血B细胞占白细胞比例>1%或占淋巴细胞比例>3%作为BCR判定标准,有的则将骨髓中CD19+细胞<1个/淋巴细胞门作为BCA定义;在计数分母选择上,部分机构以总白细胞为参照,部分则采用单个核细胞,甚至还有中心以绝对细胞数作为判定依据,如外周血B细胞>10个/μL或≥50个/μL。这种检测标准的不统一,导致不同研究结果缺乏可比性,严重影响了临床数据的解读与复发风险评估的准确性。
生物医药产业大会了解到,为解决这一问题,2025年11月,《HemaSphere》期刊发表了一项国际共识声明,该声明由多个国家的儿科CAR T细胞治疗专家联合制定。专家团队系统梳理了当前CD19-CAR T细胞治疗后B细胞监测的现状与挑战,深入分析了检测方法、监测时间点及判定阈值等因素对临床解读的影响,并结合过往临床试验数据与真实世界诊疗经验,最终提出了BCR的统一定义及标准化监测方案,为提升不同中心研究结果的可比性、优化复发风险评估与随访管理提供了重要依据。
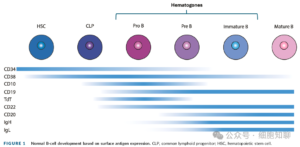
要理解BCR的监测逻辑,需先明确正常B细胞的发育特征。B细胞的发育过程以细胞表面蛋白的有序表达和免疫球蛋白基因重排为核心,最终形成具备抗体分泌功能的成熟B细胞。其早期发育阶段发生于骨髓内,从CD34⁺、CD10⁺、TdT⁺且CD19低表达的祖B细胞,逐步分化为CD34⁻、CD10⁺、CD20⁺并表达表面免疫球蛋白的未成熟B细胞,这一阶段的细胞被称为“造血祖B细胞”。随着分化进程推进,CD19的表达水平逐渐增强,至前B细胞阶段,CD22表达显著,免疫球蛋白轻链基因开始重排;成熟B细胞则会表达CD20及完整的免疫球蛋白分子,而当B细胞终末分化为CD138⁺CD38⁺浆细胞时,CD19表达水平会下降,仅在部分浆细胞中保留。
基于这一发育规律,若CD19-CAR T细胞持续具备功能,理论上患者体内不应检测到超过淋巴祖细胞阶段的B细胞;而当CAR T细胞功能丧失时,骨髓中会首先出现造血祖B细胞,随后逐步完成成熟过程并迁移至外周血及次级免疫器官。值得注意的是,部分患者在治疗后可能出现短暂性BCR,这可能与骨髓持续生成正常B细胞、且B细胞从骨髓发育到迁移至外周血存在时间延迟有关,这也提示临床不能仅凭单一检测部位或单次检测结果判断B细胞恢复状态。
图片来源:细胞知聊
在B细胞恢复监测过程中,仍面临诸多技术与实践挑战。目前临床主要采用多参数流式细胞术(MFC)进行检测,但该技术存在背景荧光干扰、补偿伪影、细胞碎片干扰等固有局限,在检测极低水平B细胞时这些问题更为突出。从检测部位来看,外周血MFC的标准化程度较高,是目前BCA监测的主要方式;而骨髓监测不仅属于侵入性操作,且易受外周血污染、样本细胞数量、有核红细胞残留、检测时间间隔等多种因素影响,不同机构的门控策略和计数标准差异也会导致结果偏差。尽管如此,持续的外周血与骨髓BCA监测仍具有重要临床价值——BCR的预后意义更多体现在定性层面,因此任何水平的可检测B细胞都可能与复发风险相关。
针对上述问题,国际共识提出了明确的标准化建议:在CAR T细胞输注后的前6个月,外周血B细胞应至少每月监测一次,报告结果时优先采用B细胞绝对数(单位:个/mcL);由于BCR通常先在骨髓中出现,再在外周血中被检测到,因此治疗早期阶段,骨髓B细胞监测应作为随访核心内容,MFC报告需定量呈现CD19阳性的成熟与未成熟正常B细胞,这一时间差为临床干预提供了宝贵窗口。
共识明确了BCR的判定标准:外周血CD19阳性B细胞≥10个/mcL,或骨髓中CD19阳性B细胞≥1%(以总白细胞或单个核细胞为分母),且上述结果需在至少间隔2周的后续检测中得到确认;BCR的发生时间以首次满足判定标准的样本采集时间为准。对于检测结果处于“潜在BCR”范围(骨髓CD19⁺细胞0.01%-<1%,或外周血CD19⁺细胞1-9个/mcL)的患者,建议加强监测频率;而对于“疑似BCR”(单次检测骨髓CD19⁺细胞≥1%或外周血≥10个/mcL)的患者,需在2周内重复检测,若结果稳定或升高则确诊为BCR。确诊后,早期BCR患者可考虑采用巩固治疗策略,晚期BCR患者则需结合病史及BCR发生时间,由医生制定个性化监测或干预方案。
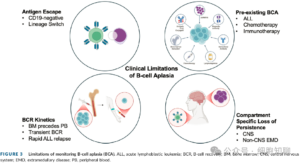
同时,临床也需认识到BCA监测的局限性。BCA并非持续缓解的完美替代指标,即使患者维持BCA状态,仍可能发生抗原阴性复发,这类复发在CD19-CAR T细胞治疗后的发生率约为15%-20%,在高疾病负荷人群中比例更高,其机制与CD19基因可变剪接、突变、治疗前已存在CD19阴性亚克隆或谱系转换等有关。此外,治疗前已存在的BCA(如由清髓/淋巴清除化疗、既往异基因造血干细胞移植或靶向B细胞药物导致)、B细胞与白血病细胞增殖能力的差异、不同检测部位BCR动力学的不同,都会影响BCA作为CAR T细胞功能性存续替代指标的有效性。其中,异基因造血干细胞移植后患者的B细胞和CD4阳性T细胞恢复通常需要6-12个月,而rituximab可导致6-9个月的BCA,blinatumomab和inotuzumab所致BCA的持续时间则尚未完全明确。
图片来源:细胞知聊
髓外病变(如中枢神经系统受累)也会对监测效果产生影响。血脑屏障及髓外部位独特的免疫微环境,可能限制CAR T细胞的归巢与功能发挥,且这类部位正常B细胞数量极少,缺乏反映CAR T细胞功能性存续的有效指标,增加了部位特异性监测的难度。
分子微小残留病灶(MRD)监测为BCA监测提供了重要补充。基于免疫球蛋白或T细胞受体(Ig-TCR)重排的PCR检测,灵敏度可达10⁻⁴至10⁻⁵;而基于VDJ互补决定区的二代测序(NGS)检测(如ClonoSEQ®),检测阈值可低至10⁻⁶,且能在形态学复发前提供更长的预警时间。临床研究显示,BCA与NGS-MRD联合应用,可显著提升复发预测的准确性,任何可检测到的非零NGS-MRD水平均提示高复发风险。目前,NGS-MRD已逐渐纳入美国CAR T细胞治疗后的临床随访,而基于外周血的NGS-MRD监测因具有无创优势,正处于积极研究阶段。
综上,BCA是评估CD19-CAR T细胞功能性存续的重要生物标志物,但受生物学变异、治疗前基础状态、抗原逃逸及技术局限性等多种因素影响,其并非长期缓解的完美预测指标。建立BCR的共识性定义与标准化监测方案,是确保不同临床场景和研究数据可比性的关键。通过明确判定阈值、规范监测频率与检测方法,临床医生可更精准地评估治疗结局、管理复发风险,尤其在治疗早期阶段及时干预,为患者争取更好的预后。未来,随着监测技术的不断优化及多生物标志物联合应用的深入探索,CD19-CAR T细胞治疗后的随访管理将更加精准高效。
文章来源:细胞知聊


