ChinaBio生物医药投融资大会关注到,在神经—代谢与消化系统交叉研究领域中,肠道神经系统(Intestinal Nervous System,INS)因其在多种疾病与生理稳态中的核心调控作用而受到高度重视。肠道不仅是消化与吸收的器官,更是一个具备高度自主神经调控能力的复杂系统,参与调节肠道蠕动、排便、液体平衡及食物摄取等关键生理过程。INS主要由两大类神经元构成:一类是将肠道与中枢神经系统相连的外源性神经元(extrinsic neurons),包括感觉神经与自主神经;另一类则是嵌入肠壁、数量最为庞大且结构最为复杂的内源性神经元,即肠神经系统(Enteric Nervous System,ENS)。长期以来,由于标记基因高度重叠、外源性与内源性神经难以区分,ENS不同神经亚群的分子特征、解剖投射及具体功能始终缺乏系统解析。

图片来源:BioArt
近日,美国哥伦比亚大学欧文医学中心 Nikhil Sharma 课题组在 Cell 发表题为 Properties and functions of transcriptionally distinct enteric neurons 的研究论文,系统建立了一套精确区分并操控内源性与外源性肠神经元的遗传学工具,全面解析了不同转录学类型的ENS神经元在解剖投射、功能分工以及与外源神经系统互作中的作用机制。
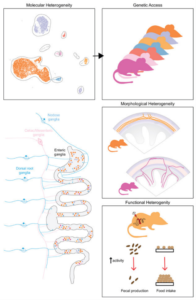
研究首先在分子与空间层面对肠神经元进行精确标记。作者利用由 Elavl4 基因驱动的 FlpOERT2 / CreERT2 重组系统,实现了对全肠神经元(pan-enteric)的特异性标记,并结合单细胞RNA测序(scRNA-seq)鉴定出八个主要的转录学亚群(α、β、γ、δ、ε、ζ、η、θ)。在此基础上,研究团队依据 Oprk1、Cck、Gad2、Sst 等差异表达基因,构建了相应的 Cre/FlpO 驱动系统,并通过 AAV 局部注射实现胃、小肠和结肠等不同肠段的区域特异性标记,从而能够独立操控每一个ENS转录亚群。
在遗传工具建立完成后,作者系统分析了各神经元亚群在肠道中的空间分布、轴突投射模式及形态学特征。通过 Cre–Flp 双重重组策略消除外源性神经元的标记干扰,研究发现,不同ENS亚群具有高度特异的解剖投射:α 与 β 亚群主要支配环形平滑肌,分别对应兴奋性与抑制性运动神经元;γ 亚群投射至腹腔与肠系膜神经节;δ 与 ζ 亚群属于肠内中间神经元;而 θ 与 η 亚群则主要分布于肠绒毛和腺体区域。结合神经递质类型与基因表达谱,作者进一步界定了各亚群的神经化学属性。
在功能层面,研究人员利用化学遗传学手段选择性激活不同ENS亚群,并系统评估其对肠道生理的影响。结果显示,激活 α 和 β 亚群可显著加快肠道运输并促进排便;激活 γ、δ 和 η 亚群则抑制排便并减少食物摄取;而 θ 与 η 亚群的激活可增加粪便含水量。这些结果清晰表明,不同ENS转录亚群分别调控肠道功能的不同环节,且下肠段神经元对整体肠道生理的影响尤为直接。
传统观点认为 ENS 具有高度自主性,能够在缺乏中枢输入的情况下独立调控肠功能。然而,该研究进一步揭示,部分ENS亚群需要通过与外源性神经元的协作才能实现复杂调控。作者分别标记并追踪交感神经、迷走神经和感觉神经在肠壁中的投射,发现这些外源性神经与肠神经节形成了高度致密的突触网络。以功能显著的 γ 亚群为例,研究显示其抑制排便依赖交感神经通路,而抑制进食则需要背根神经节(DRG)感觉通路的参与。进一步的分子机制研究表明,γ 亚群激活后释放胆囊收缩素(CCK),通过 DRG 将肠道状态反馈至中枢,从而调节食欲相关神经环路。这些结果明确表明,ENS 并非完全独立运行,而是通过与外源神经系统共同构成肠—脑—交感整合网络,实现对排便与进食的精细调控。
图片来源:BioArt
综上,该研究首次在分子、解剖与功能层面对肠神经系统进行了系统性解析,建立了区分内源性与外源性神经元的遗传学工具体系,揭示了不同ENS亚群的功能分工及其与外源神经网络的协同机制,突破了肠神经系统“完全自主”的传统认知。ChinaBio生物医药投融资大会认为,这一成果为深入理解肠—脑—代谢调控网络提供了坚实的理论与技术基础,也为相关疾病的机制研究和药物研发提供了新的切入点。
文章来源:BioArt


