食管鳞状细胞癌(ESCC)作为全球第七大恶性肿瘤,占食管癌病例的90%,其高死亡率与现有诊断方法的局限性密切相关。生物医药产业大会了解到近期发表于《Advanced Science》的研究通过整合微流控生物芯片技术与机器学习算法,开发出一种基于血清小细胞外囊泡(sEVs)蛋白质组分析的早期诊断平台,将ESCC诊断准确率提升至90.8%,为癌症早筛领域带来革命性进展。

图片来源:互联网
一、传统诊断方法的困境与突破需求
当前ESCC筛查主要依赖内镜检查和组织活检,存在三大痛点:
- 侵入性风险:内镜需经咽喉插入,易引发患者不适;
- 成本与可及性:需专业设备及操作人员,基层医疗难以普及;
- 灵敏度不足:现有液体活检技术(如cfDNA检测)对早期病例敏感性不足20%。
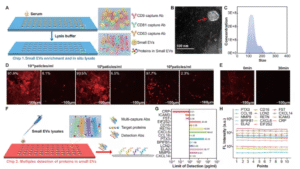
研究团队另辟蹊径,选择sEVs作为检测靶标——这类直径30-150nm的囊泡由细胞主动分泌,携带母体细胞特异性蛋白标记,能克服肿瘤异质性的干扰。
二、技术创新双核心:生物芯片与AI模型
(一)微流控生物芯片设计亮点
- 高效捕获系统:采用氧化石墨烯量子点(GOQDs)修饰基底,固定CD63/CD81/CD9混合抗体,sEVs捕获效率超90%;
- 原位裂解技术:30分钟内完成囊泡裂解,释放内部蛋白;
- 高通量检测:单芯片可同步分析60个样本,每个样本检测14种蛋白,检测限低至0.01pg/mL。
(二)机器学习模型构建路径
- 标志物筛选:通过4D-DIA质谱技术分析30例样本,从2000+种sEVs蛋白中筛选出14个差异表达蛋白;
- 模型优化:基于273例多中心临床数据,最终确定9种核心标志物(如ANXA1、S100A8等)构建9-DM诊断模型;
- 性能验证:在独立测试集中,模型对I-II期ESCC的识别准确率达90.8%(AUC=0.93),显著优于传统标志物SCC(AUC=0.51)。
三、临床价值与推广潜力
该平台展现出三大优势:
- 早期诊断:在无症状阶段即可检出肿瘤,较现有方法提前6-12个月;
- 特异性强:对结直肠癌、乳腺癌等交叉样本的误判率低于5%;
- 成本效益:单次检测成本约为内镜检查的1/3,适合大规模筛查。
研究者特别指出,该技术框架可拓展至肝癌、胰腺癌等其他恶性肿瘤的早诊体系,目前已完成胃癌标志物的初步验证。
图片来源:互联网
四、未来展望
尽管成果显著,团队仍计划从三方面优化:
- 扩大样本量至5000例,进一步验证模型稳定性;
- 开发便携式检测设备,实现基层医疗机构落地;
- 探索sEVs蛋白动态变化与治疗效果的相关性。
生物医药产业大会认为这项研究标志着液体活检技术从科研向临床转化的重要里程碑,为癌症早诊早治提供了全新范式。
文章来源:生物谷


